Вторичные метаболиты растений. Классификация вторичных метаболитов. Изопреноиды и алкалоиды.
Автор: Вишневская А.И.
Ещё в древней Греции учёные-философы обратили внимание на то, что многие растения имеют лекарственные свойства. Например, Гиппократом было описано применение более 230 видов лекарственных растений. Сейчас нам хорошо известно, что растения обладают полезными свойствами, поскольку они содержат особые вещества. Как синтезируются эти вещества в растении, что собой представляют и каков механизм их действия – над решением всех этих вопросов трудятся и современные учёные из разных областей наук, однако кое-что науке уже известно. Попробуем разобраться в этом.
Растения, кроме углеводов, аминокислот и разнообразных липидов, способны синтезировать особые вещества, называемым «вторичным метаболитам». Подобное название впервые дал таким веществам немецкий биолог, лауреат Нобелевской премии 1910 года, Альбрехт Коссель. Так он навал соединения, которые присутствуют не в каждой растительной клетке и которые, как он считал, не играют решающую роль для жизни клетки. Действительно, подобные соединения синтезируются далеко не в каждом растении и не в каждой его клетке, однако их роль в клетке растений Косселем была недооценена.
Тогда какие соединения можно называть вторичными метаболитами?
- Относительно низкомолекулярные соединения;
- Не обязательно присутствующие в каждом растении;
- Как правило, являющиеся биологически активными соединениями;
- Синтезирующиеся из немногих первичных метаболитов.
Для некоторых соединений такая классификация весьма условна и их нельзя однозначно отнести к первичным или вторичным метаболитам. Часто их синтез сопряжен с путями биосинтеза первичных метаболитов (например, аминокислот и изопреноидов), а классификация прежде всего основана на структурных особенностях веществ, и в меньшей степени на биосинтезе.
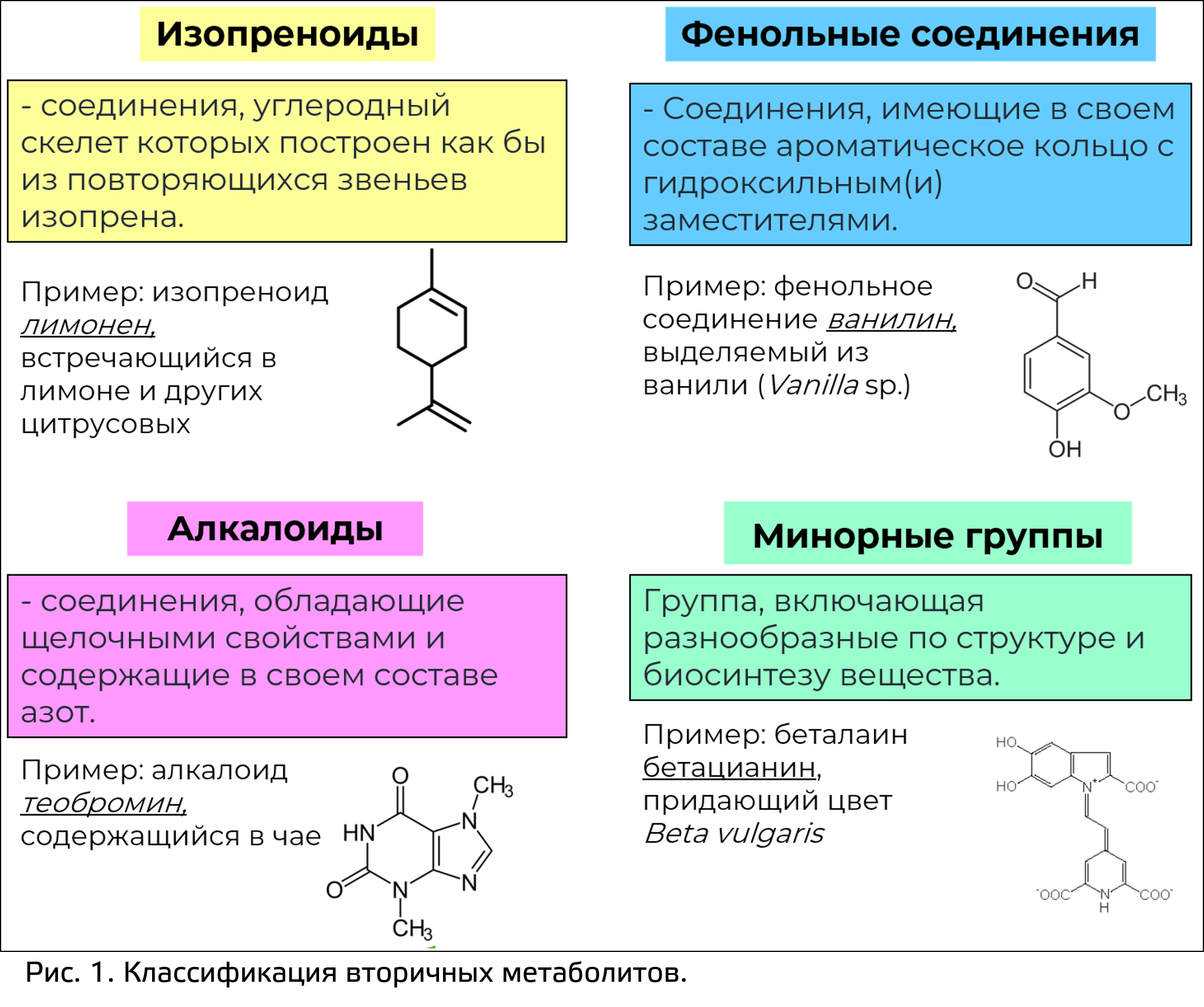
На сегодняшний день выделяют 3 основных класса вторичных метаболитов (рис. 1):
- Изопреноиды;
- Алкалоиды;
- Фенольные соединения;
- а также сборную группу из минорных соединений.
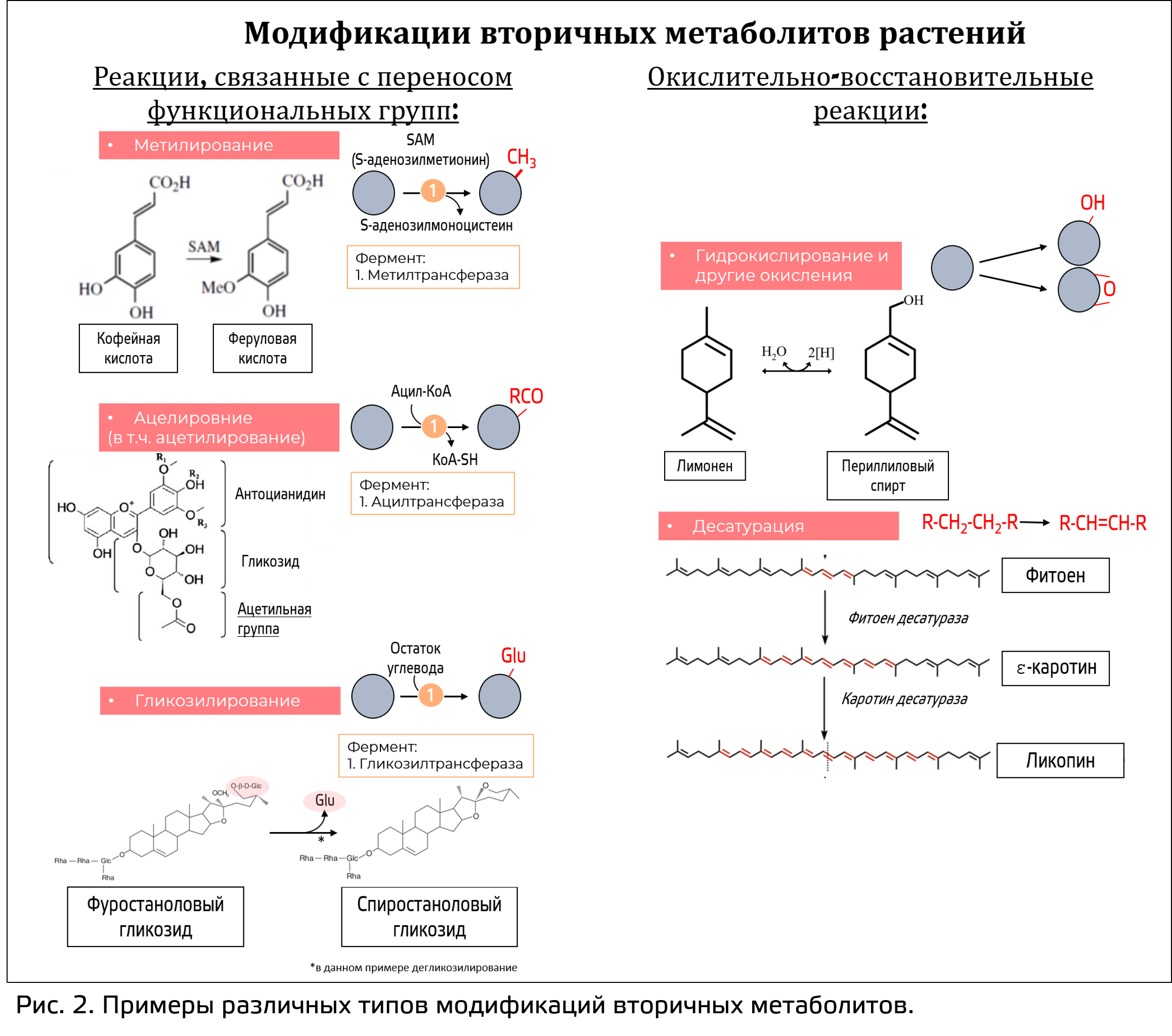
Все эти группы отличаются по химической структуре, однако подобный базовый скелет может подвергаться модификациям. Наиболее широко распространены следующие типы модификаций (рис. 2):
- Метилирование – это присоединение метильной (CH3) группы. Донором подобной группы является вещество, участвующее и в первичном метаболизме, – S-аденозилметионин (SAM). SAM – это кофактор фермента метилтрансферазы, переносящего метильную группу. Метилирование может происходить по разным химическим элементам в составе скелета.
- Ацилирование – это присоединение остатка карбоновой кислоты (в случае присоединения остатка уксусной кислоты такой процесс называется ацетилированием). Здесь работает ферменты ацилтрансферазы, которые осуществляют перенос ацильных групп с донора — ацил-КоА.
- Гликозилирование – это присоединение к веществу остатков сахаров. Частный случай – глюкозилирование, то есть присоединение остатка глюкозы Подобное присоединение остатка сахара осуществляют гликозилтрансферазы – растворимые цитозольные белки, использующие в основном УДФ-сахара. Гликозилирование может также происходить по разным химическим элементам в составе скелета.
- Гидроксилирование и другие окислительные реакции, приводящие к появлению атома кислорода в молекуле вторичного метаболита.
- Десатурация - дополнительно вноситься двойная связь.
Первые три модификации связаны с переносом функциональных групп, осуществляемыми ферментами трансферазами. Последние две модификации связаны с окислительно-восстановительными реакциями и работой ферментов оксидоредуктаз.
Как было сказано выше, Альбрехт Коссель, вводя термин «вторичные метаболиты» недооценил их роль и писал о том, что они не необходимы для жизни растений. Однако это не совсем так, и более того, синтез многих вторичных метаболитов строго регулируется в организме растения. Основными гормонами, индуцирующими синтез вторичных метаболитов, являются жасмонаты и этилен. Основными физиологическими функциями вторичных метаболитов в организме растения являются:
1. Защитная. Не зря многие вторичные метаболиты ядовиты и для человека. Вырабатывая многие вторичные метаболиты, растение пытается защититься от поедателей. Кроме того, некоторые вторичные метаболиты вырабатываются для защиты от абиотических факторов, к примеру в качестве антиоксидантов и осмопротекторов. Функционально выделяют три группы защитных вторичных метаболитов: индуцибельные вторичные метаболиты (их синтез начинается только в ответ на атаку патогеном), полуиндуцибельные вторичные метаболиты (их неактивная форма накапливается в растении в течение все жизни, но активная образуется только при атаке патогена (рис. 3)), конститутивные вторичные метаболиты (накапливаются в растениях всегда).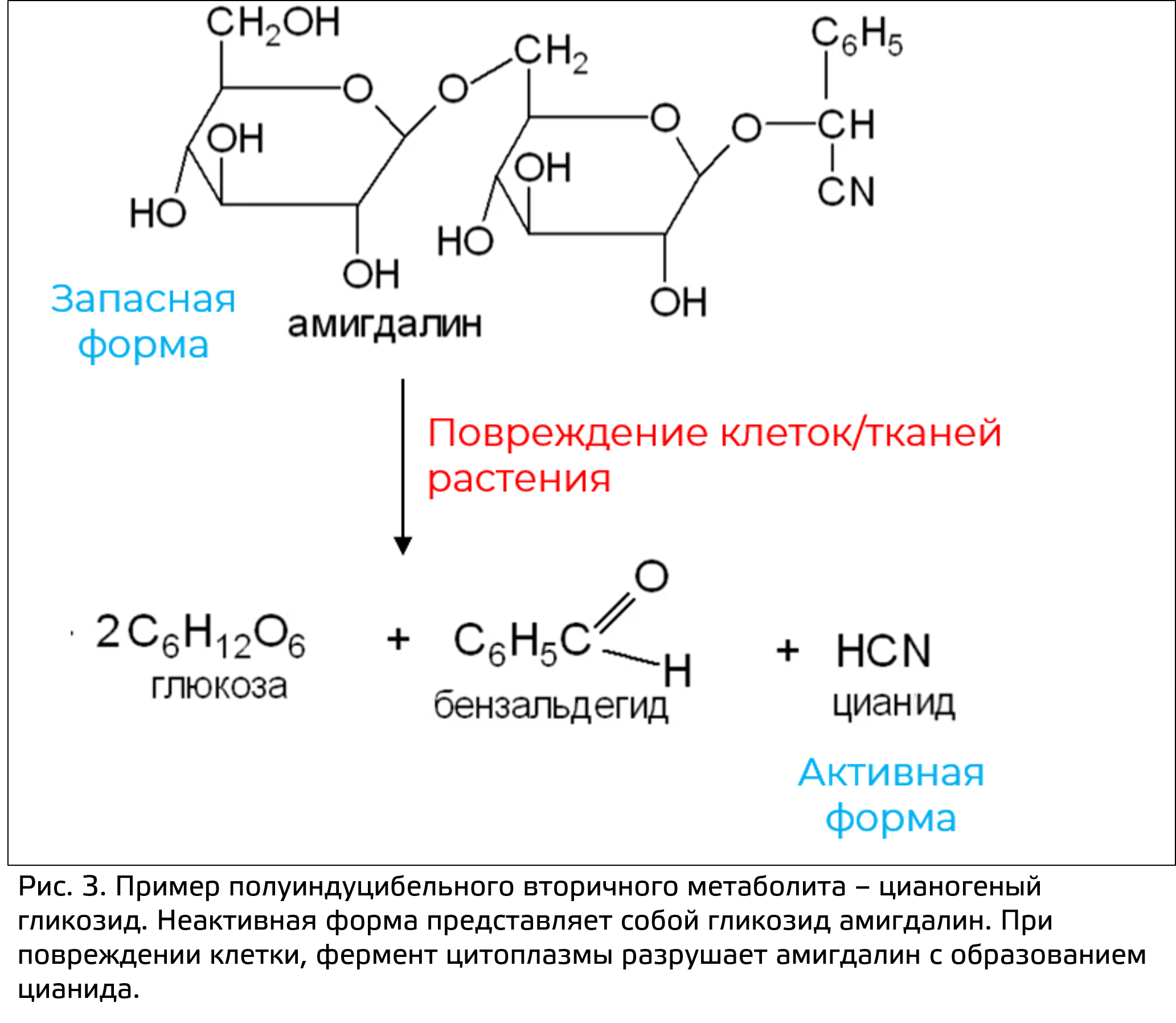
2. Аттрактантная. Нередко вторичные метаболиты наоборот служат для привлечения, например, опылителей благодаря красящим (рис. 4) или летучим веществам.

3. Запасная функция. Некоторые учёные считают, что такую функцию могут выполнять азотсодержащие вторичные метаболиты из группы беталаинов (см. рис. 1). Эти соединения встречаются только у растений порядка Гвоздичноцветные, в частности у свеклы (Beta vulgaris). Бетанин придаёт корнеплодам свеклы красный цвет, а накопление этих соединений может быть связано с запасанием азота в подобной форме. Однако точная физиологическая роль этого соединения в корнеплодах свеклы неясна.
Изопреноиды.
К изопреноидам относятся все соединения, производные изопрена (рис. 5).

Такие соединения не обязательно являются вторичными метаболитами. К примеру, каротиноиды имеют также изопреноидную структуру, однако они участвуют в первичном метаболизме: важны для улавливания света в процессе фотосинтеза, а также, например, для синтеза некоторых сигнальных веществ в растении, таких как гиббериллин и абсцизовая кислота.
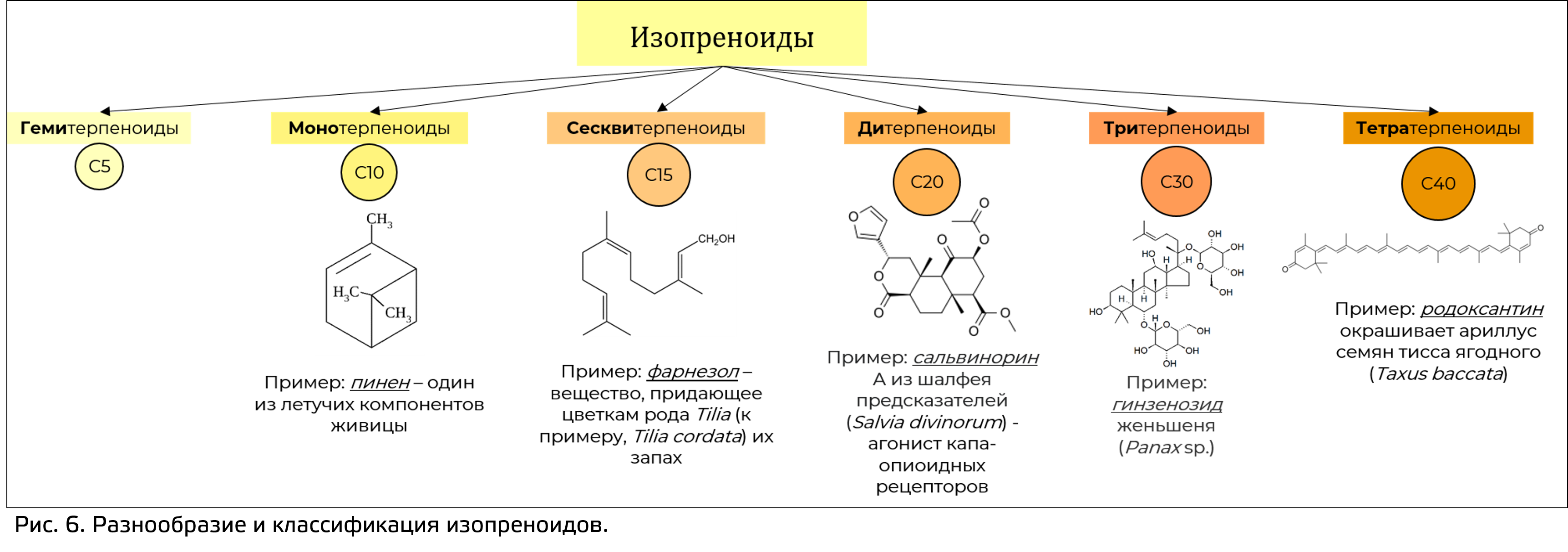
В основе классификации изопреноидов лежит число атомов углерода (рис. 6):
- гемитерпены (содержат 5 атомов углерода);
- монотерпены (содержат 10 атомов углерода);
- сесквитерпены (содержат 15 атомов углерода);
- дитерпены (содержат 20 атомов углерода);
- Сестертерпены (содержат 25 атомов углерода);
- Тритерпены (содержат 30 атомов углеродам);
- Тетратерпены (содержат 40 атомов углерода).
Бывают и исключения. Например, соединение образуется из предшественника с большим числом атомов углерода, но часть из них теряется по ходу биосинтеза. К таким соединениям относятся апокаротиноиды: соединения, образованные из тетратерпеновых каротиноидных предшественников, но потерявшие часть атомов в результате биосинтеза.
Биосинтез изопреноидов.
У изопреноидов есть два пути биосинтеза (рис. 7):
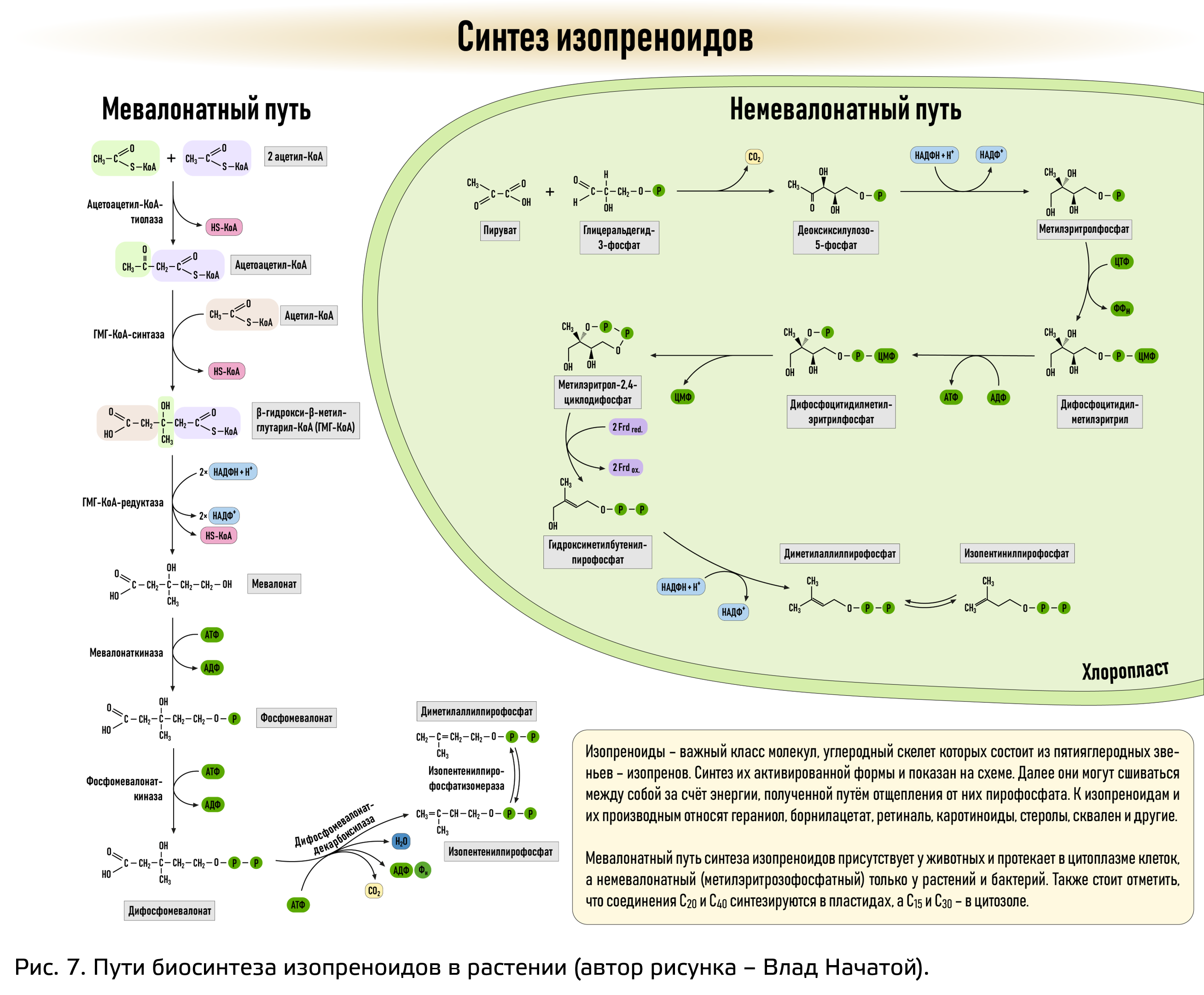
- Цитозольный, называемый также ацетатно-мевалонатный путь.
Он также имеется у нас в организме и именно благодаря ему у нас синтезируются, например, стероидные вещества. - Пластидный, или метил-эритрозофосфатный путь.
Этот путь идет только в пластидах, поэтому имеется только у эукариот, имеющих эти органоиды, а также у прокариот.
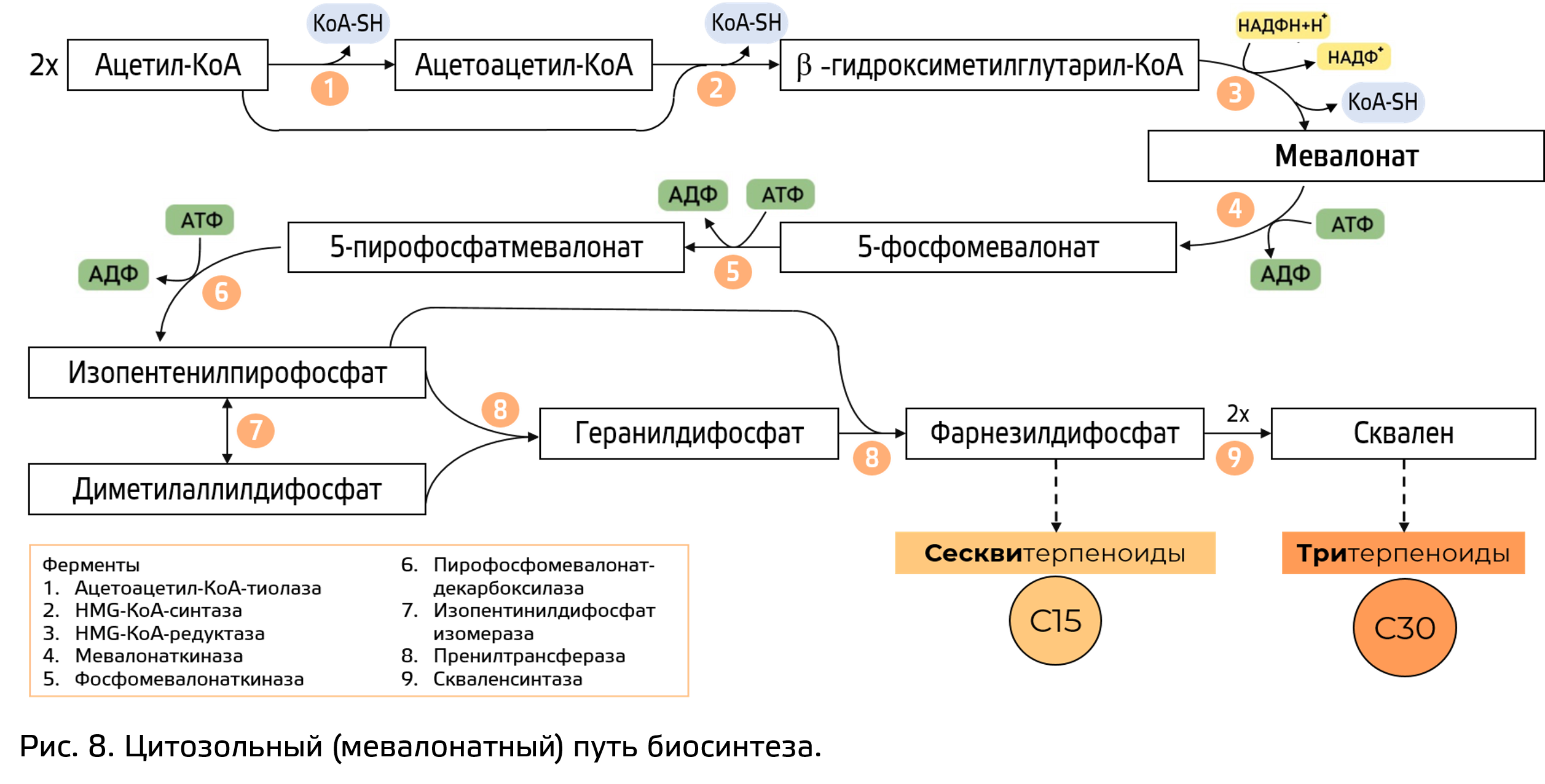
Ацетатно-мевалонатный путь (рис. 8) начинается с двух молекул ацетила-КоА (об этом подсказывает название пути), которые последовательно конденсируются и образуют специфичный для данного пути продукт – мевалоновую кислоту. Далее она в ходе последовательных реакций превращается в изопентенилдифосфат (С5-предшественник). Фермент изопентинилдифосфата-изомераза может изомеризовать изопентинилдифосфат в диметилаллилдифосфат, после чего эти два С5-соединения могут вступить в реакцию с образованием геранилпирофосфата (С10 соедиения). Затем к нему зачастую присоединяется еще одно С5-соединение, образуются простейший сесквитерпеноид – фарнезилдифосфата. Далее происходит наращивание скелета путём димеризации. Таким образом из С15 соединения сразу получается С30 – фарнезилдифосфат.
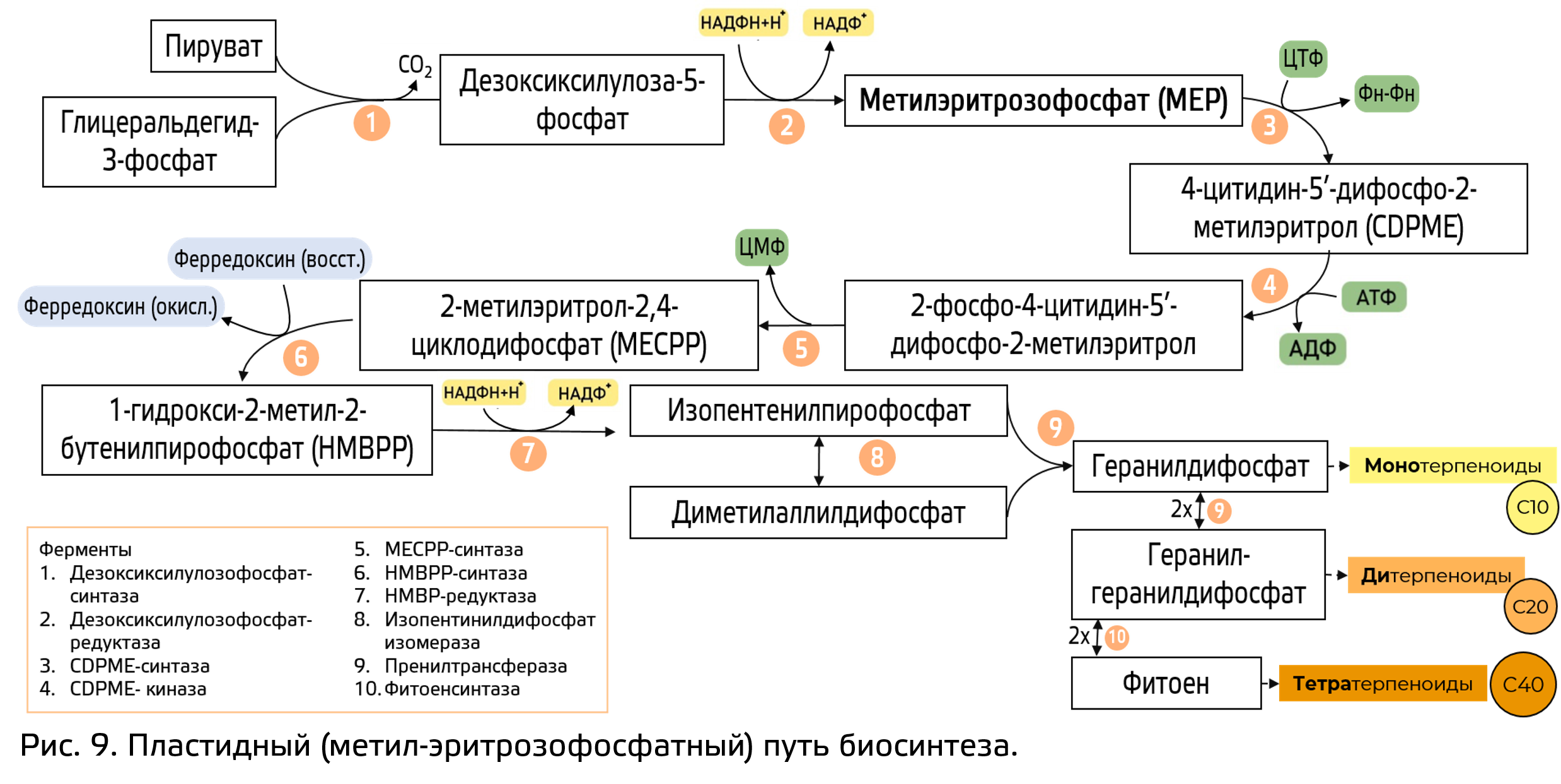
Пластидный путь биосинтеза, или немевалонатный, или метил-эритрозо-фосфатный путь (рис. 9) берет свое начало из С3-соединений: пирувата и 3-фосфоглицеринового альдегида. Его главные особенности – промежуточный продукт метил-эритрозофосфат, а также то, что в результате биосинтеза может образоваться одновременно молекула и изопентинилдифосфата, и диметилаллилдифосфат. Далее также происходит конденсация изопентинилдифосфата и диметилаллилдифосфата, в результате чего образуется С10 соединение. Так образуется большинство монотерпеноидов. С10 соединение может вступить в димеризацию, дав начало дитерпеноидам. Они же в свою очередь также могут димеризоваться, давая начало С40 соединениям – тетратерпеноидам.
Есть и другие терпеноиды: кол-во С5 фрагментов в них (например, каучуке или гуттаперчи) может быть больше сотни. Такие вещества накапливаются в специальных структурах и имеют защитную функцию, но биосинтез изучен крайне слабо.
Разнообразие изопреноидов.
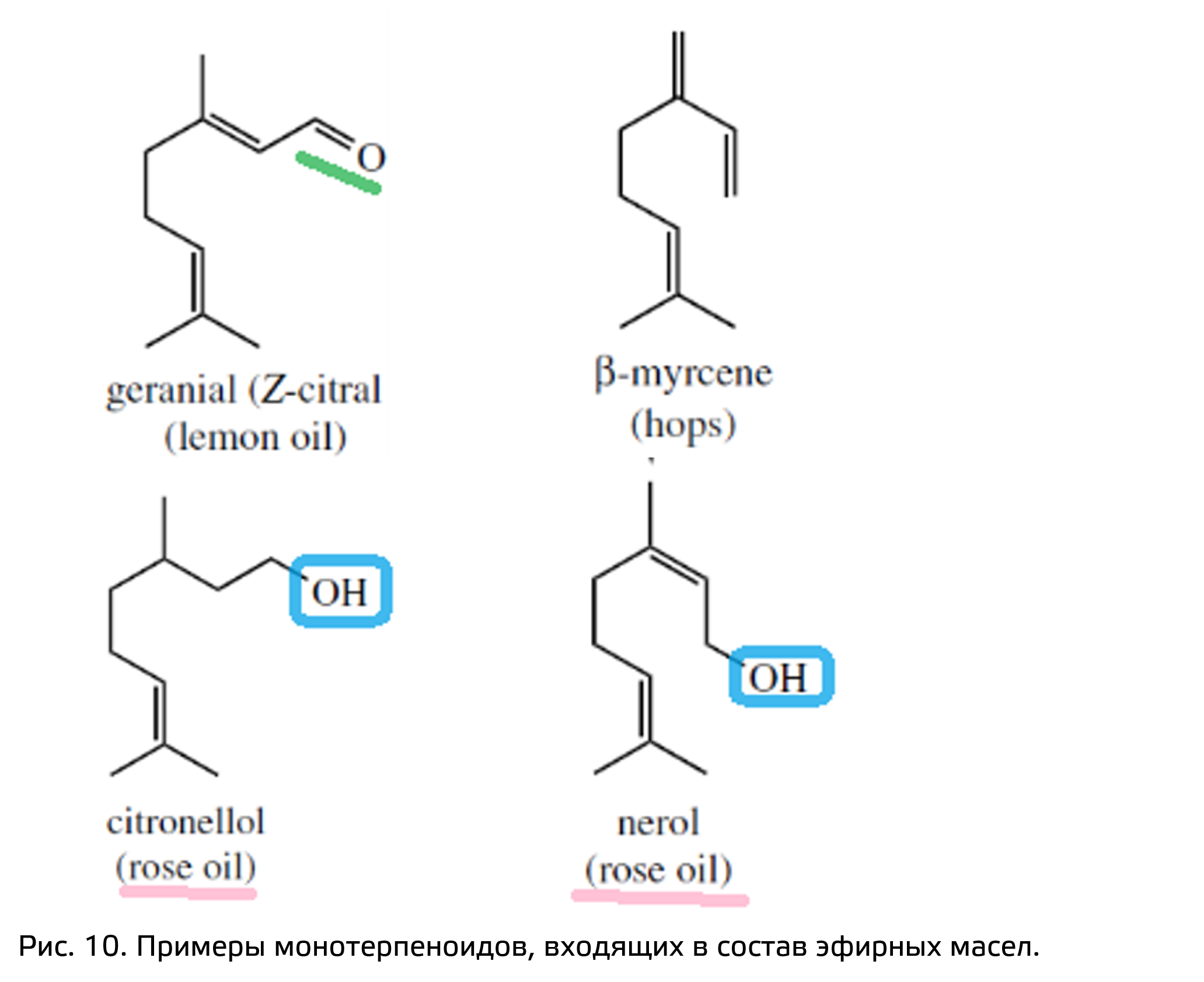
Монотерпеноиды можно найти, например, в эфирных маслах (рис. 10). Их структура может быть ациклической, а может содержать один или два цикла. Нередко монотерпеноиды гликозилируются, из-за чего их становиться легко спутать с фенольными соединениями.
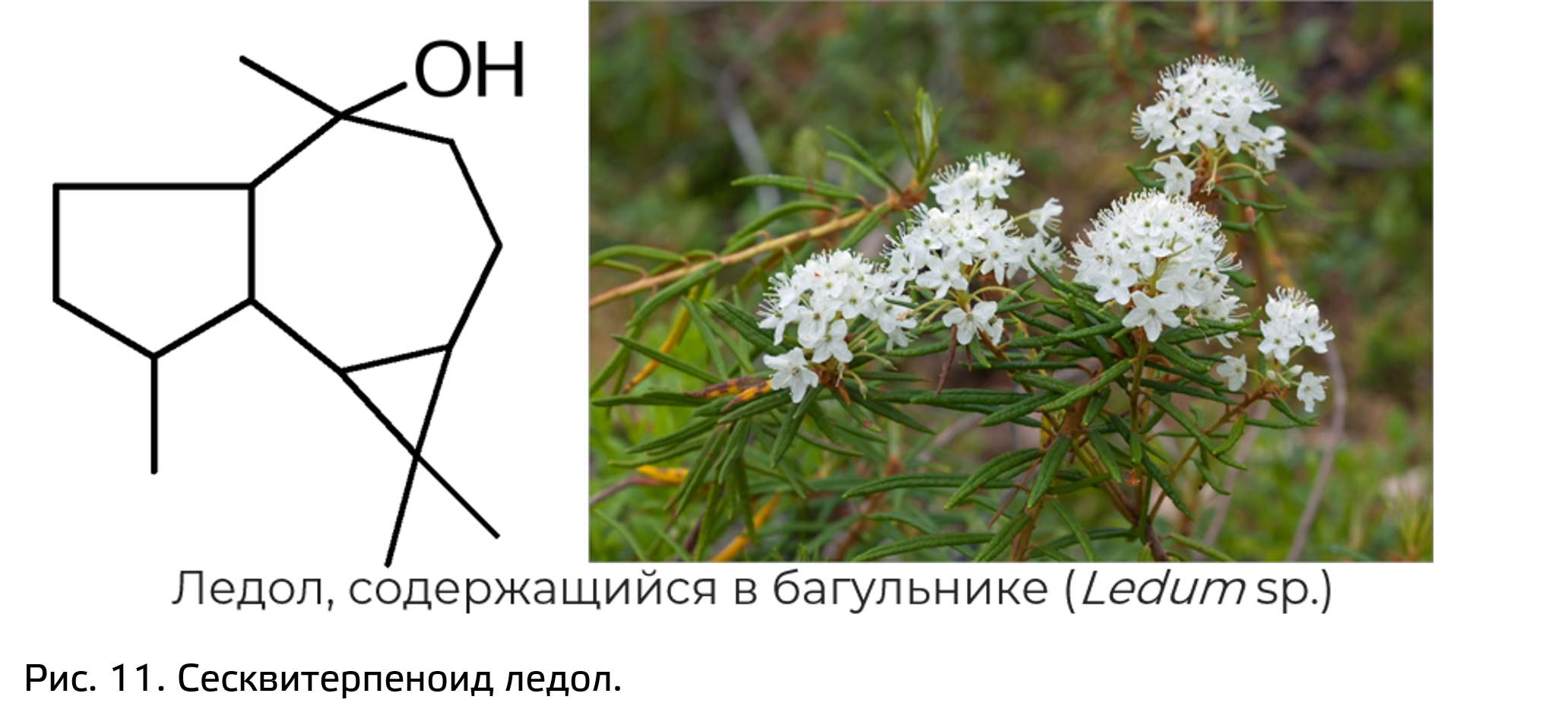
Сесквитерпеноиды также достаточно часто содержат в своем составе один или несколько циклов и являются летучими соединениями. Ярким примером является ледол из Ledum sp. (рис. 11). Ледол – летучее ядовитое соединение, которое в небольших количествах может использоваться как лекарственное средство.
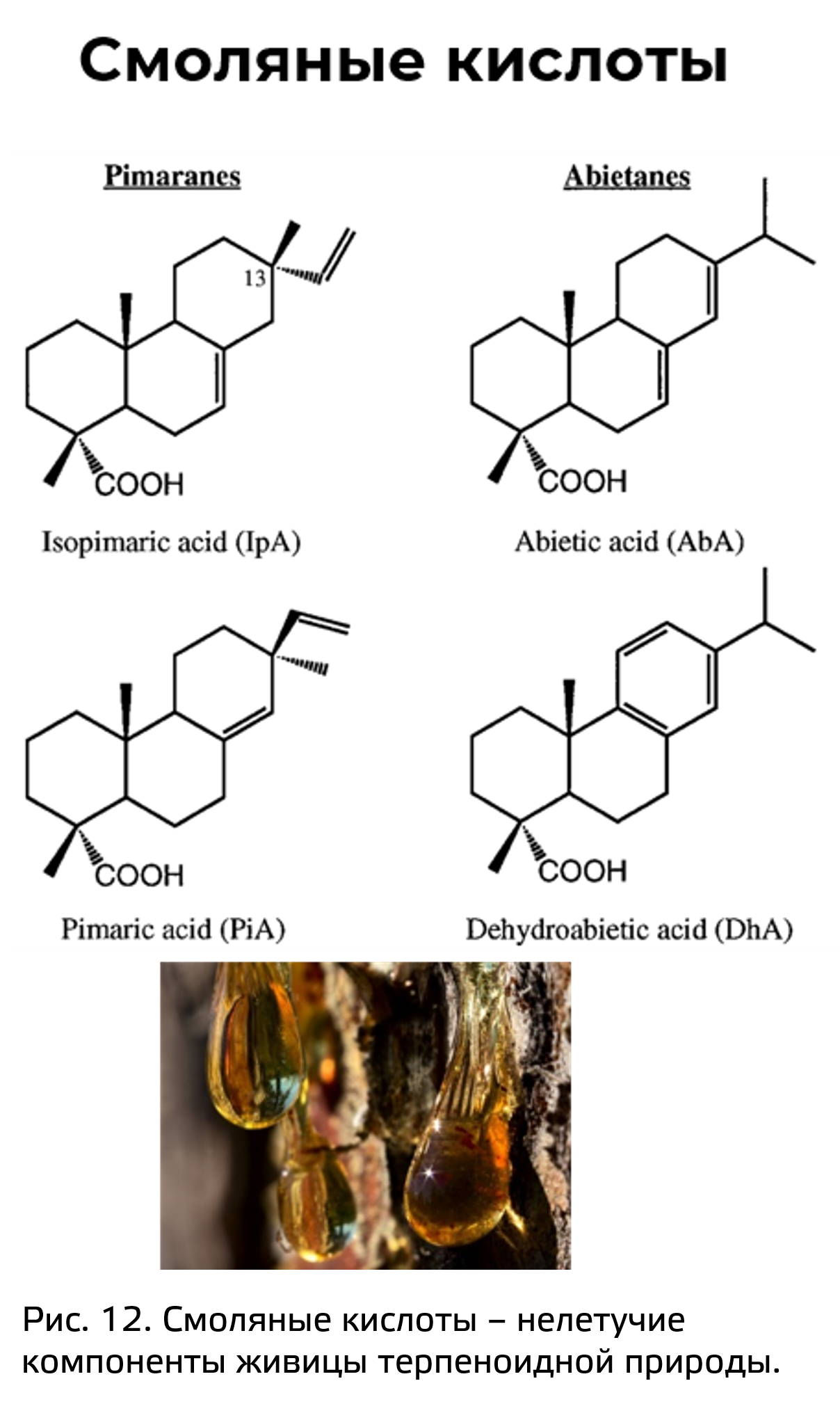
Дитерпеноиды с тремя циклами (трициклические) можно найти в смоле хвойных растений. Там они представляют собой нелетучие компоненты живицы – смоляные кислоты (рис. 12).
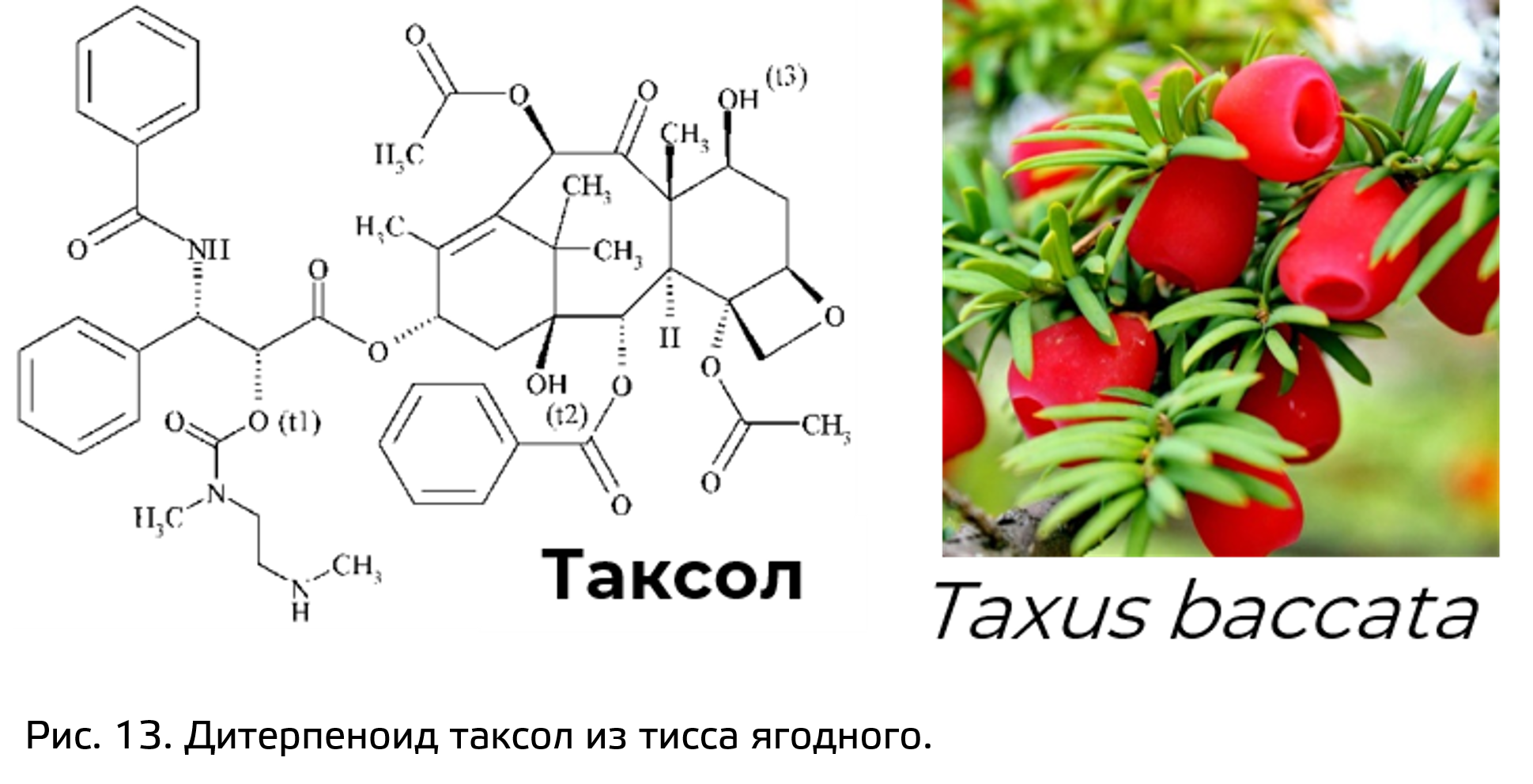
Кроме того, интересным, но в то же время сложным по структуре веществом является таксол из растений рода Taxus (рис. 13). Это вещество ингибирует разборку микротрубочек, из-за чего нарушает нормальное деление клеток. Это свойство интересует учёных, занимающихся разработкой эффективных лекарственных средств от онкологии. Интересно, что последние исследования показывают, что таксол продуцируют эндотрофные грибы рода Fusarium, живущие в тканях тисса.
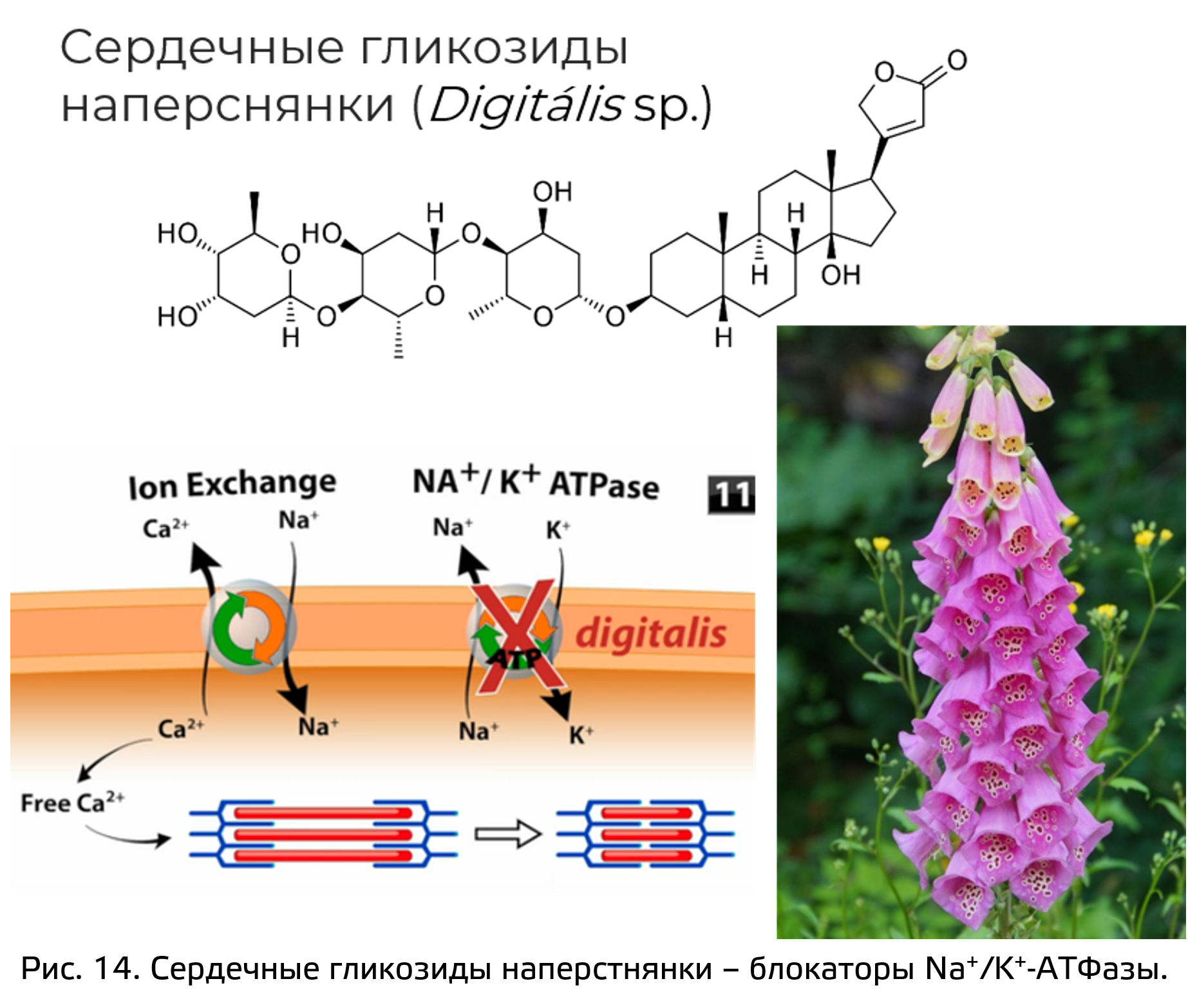
К тритерпеноидам в частности относятся вещества стероидной природы, утратившие в ходе биосинтеза несколько атомов углерода. Например – сердечные гликозиды (карденолиды и буфадиенолиды), встречающиеся, например, в роде Digitalis (рис. 14). Они выступают в качестве ингибиторов натрий-калиевой АТФазы. Это в свою очередь уменьшает разницу концентрации натрия снаружи и внутри клетки, а это приводит к тому, что перестает работать натрий-кальциевый обменник (антипорт с кальцием, вторично активный транспорт), кальция в клетке становиться больше и это приводит к более сильному сокращению сердечной мышцы.
Все соединения терпеноидной природы, имеющие 40 атомов углерода можно назвать каротиноидами, и вы о них наверняка слышали, если изучали тему фотосинтетичесиких пигментов. Однако пигменты у растений бывают не только фотосинтетическими, но и выполняющими функцию привлечения опылителей и распространителей. Например, золотисто-желтый цвет цветам календулы придает вещество флавоксантин, а красный цвет томатам – ликопин (рис. 15).
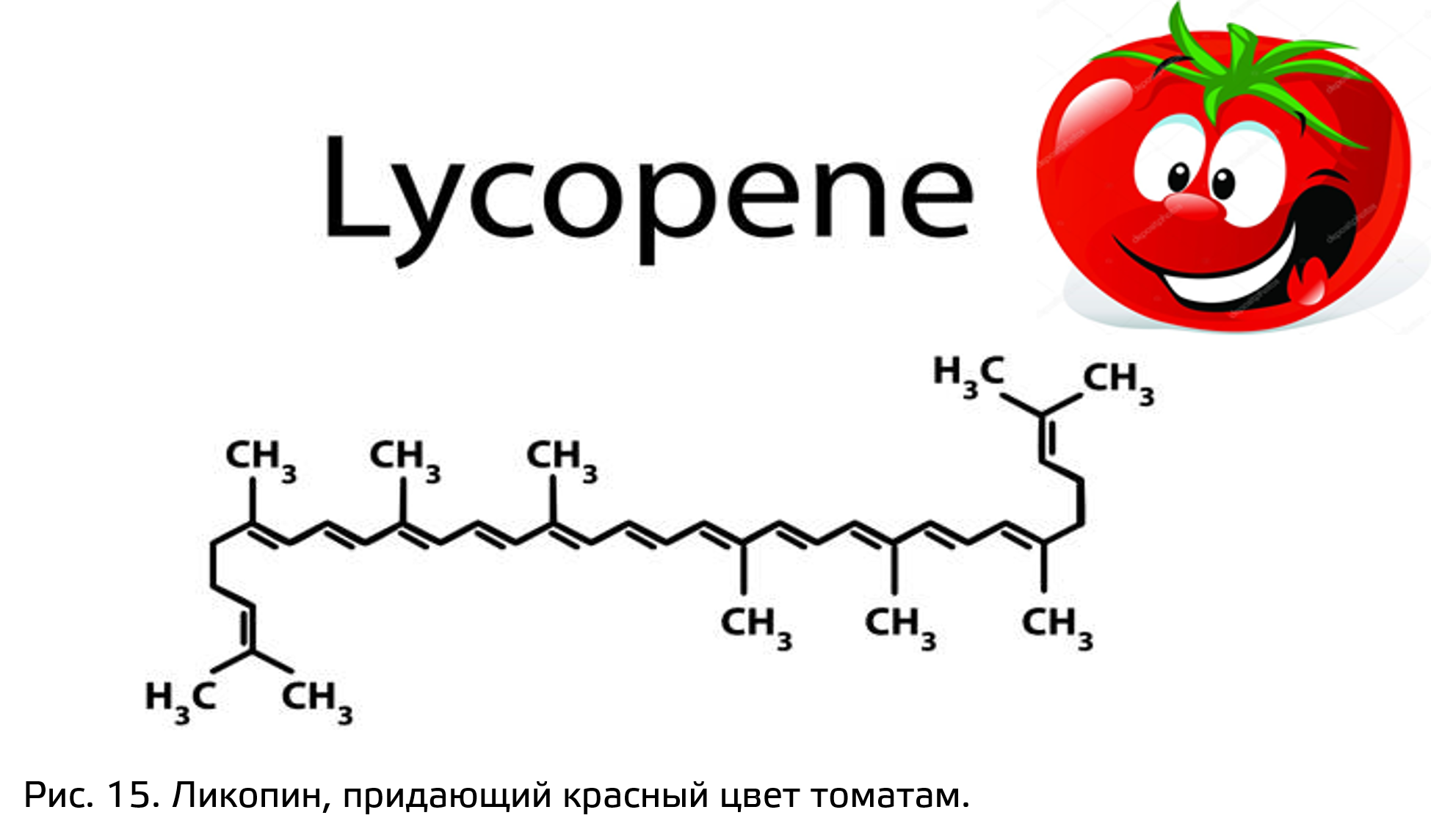
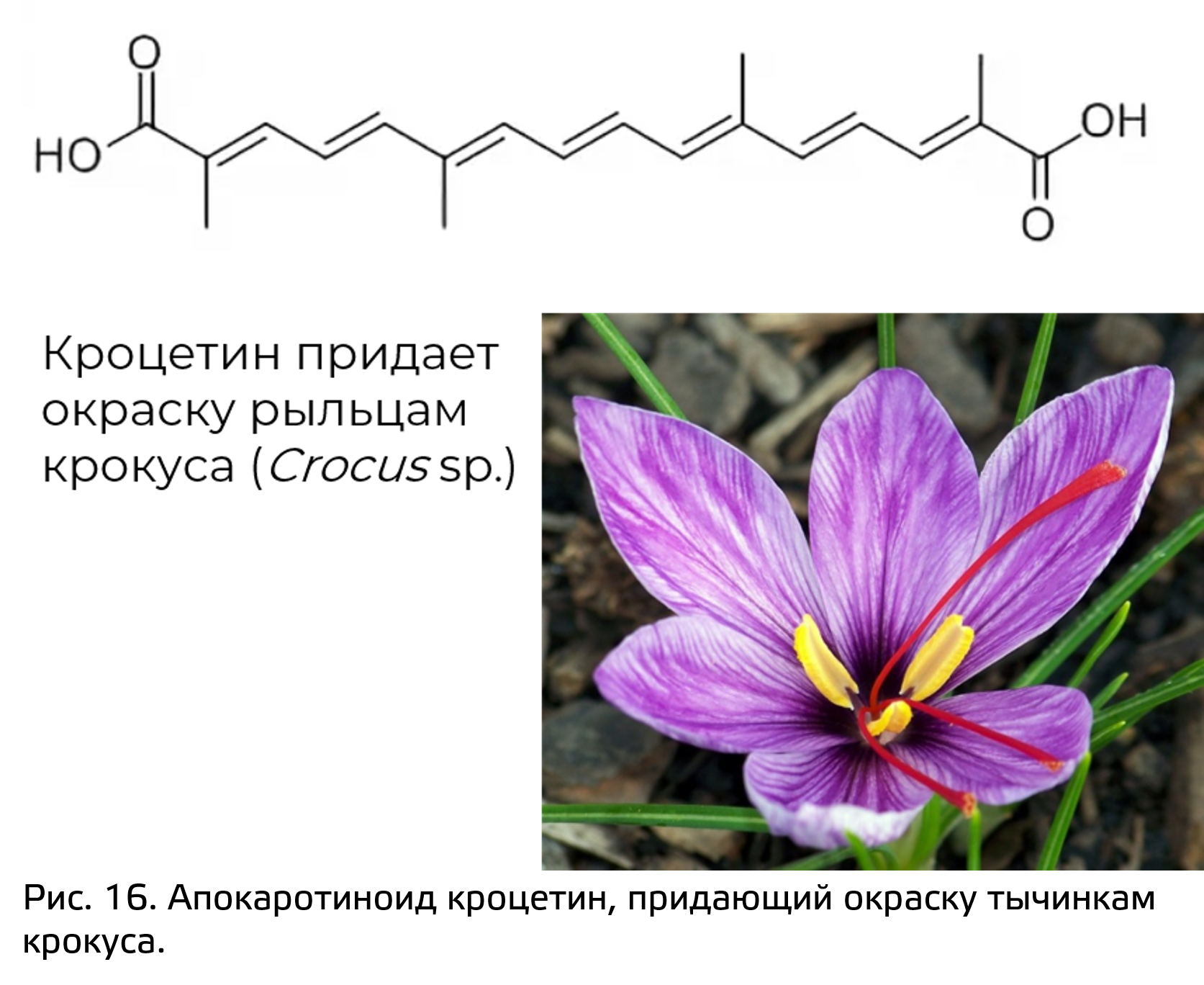
Иногда часть атомов углерода утрачивается в ходе биосинтеза. Такие соединения называются апокаротиноидами. Например, таким веществом является кроцетин (рис. 16.) – красящее вещество, находящееся в рыльцах крокуса.
Алкалоиды.
Алкалоиды представляют собой очень широко распространенную и важную группу вторичных метаболитов. В состав всех этих соединений входит азот.
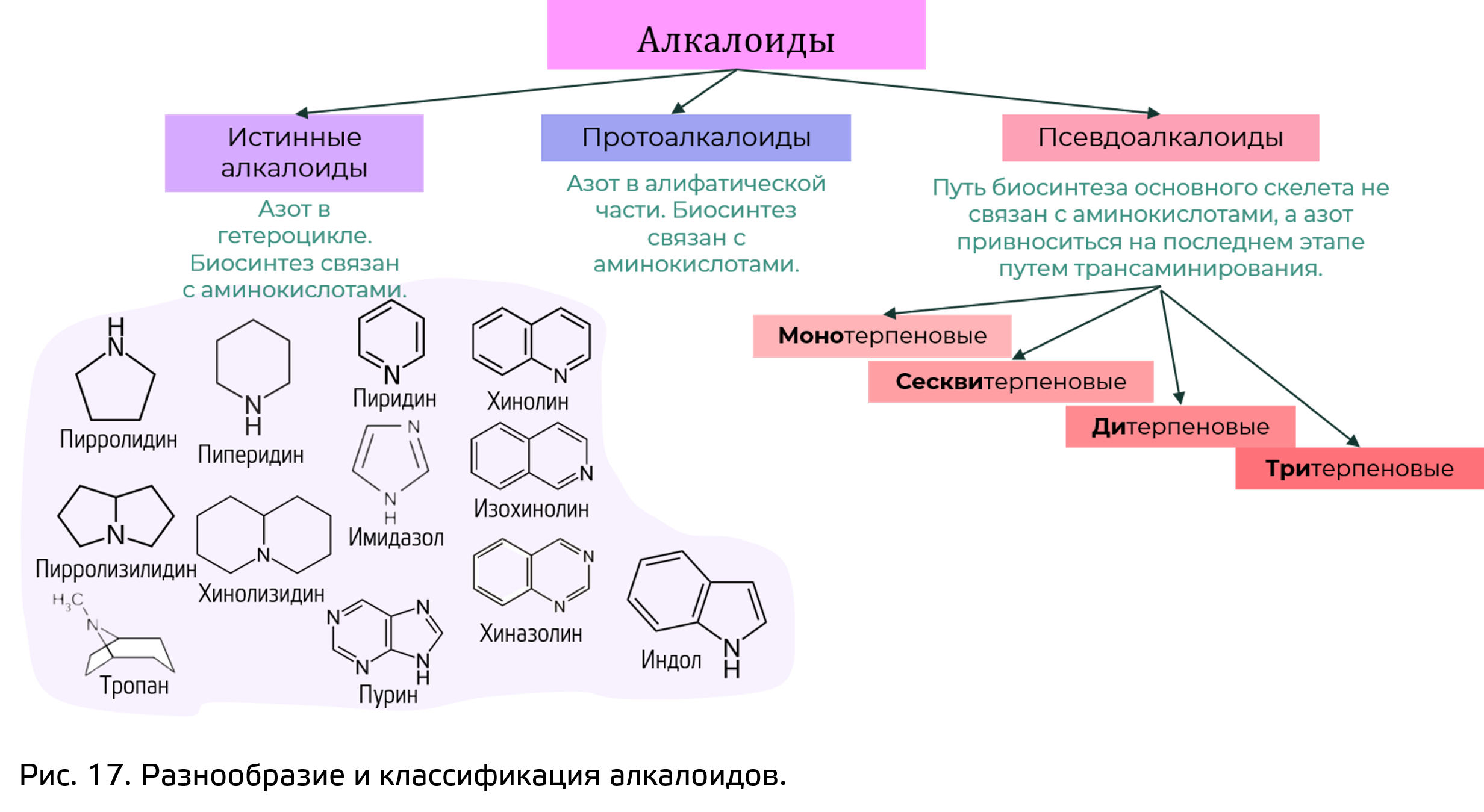
Все алкалоиды можно разделить по структуре на (рис. 17):
- Истинные алкалоиды: Атом азота в гетероциклической системе (моноциклические, бициклические соединения), при этом значительная часть углеродного скелета и атом азота происходят из соответствующей аминокислоты.
- Протоалкалоиды: Азот находиться вне цикла, в алифатической части.
- Псевдоалкалоиды: кроме того выделяют алкалоиды, которые не связаны биосинтетически с обменом аминокислот и в которые атом азота привноситься на последних стадиях биосинтеза.
Алкалоиды зачастую выполняют защитные свойства в растении и являются ядовитыми для животных веществами. По структуре их можно легко перепутать с некоторыми минорными группами. Например, с беталаинами или биогенными аминами. Их часто выделяют отдельно, поскольку беталаины не обладают токсичными свойствами для других организмов, а чаще служат для окрашивания тех или иных частей растения, а биогенные растительные амины отличаются тем, что к ним относятся вещества, играющие в нашем организме непосредственную физиологическую роль.
Биосинтез алкалоидов.
Истинные и протоалкалоиды синтезируются как правило из аминокислот.
Поскольку разнообразие аминокислот, из которых могут синтезироваться алкалоиды, очень большое, мы разберём лишь общий принцип биосинтеза некоторых истинных алкалоидов на отдельных примерах.
Разберем для начала истинные алкалоиды из группы пирролидиновых, пиролизидиновых и тропановых алкалоидов. Все они берут свое начало из непротеиногенной аминокислоты орнитин (рис. 18).
Синтеза большинства истинных алкалоидов начинается с того, что от аминокислоты отщепляется СО2 (идет реакция декарбоксилирования), после чего образуется специфичный амин – предшественник целых групп алкалоидов.
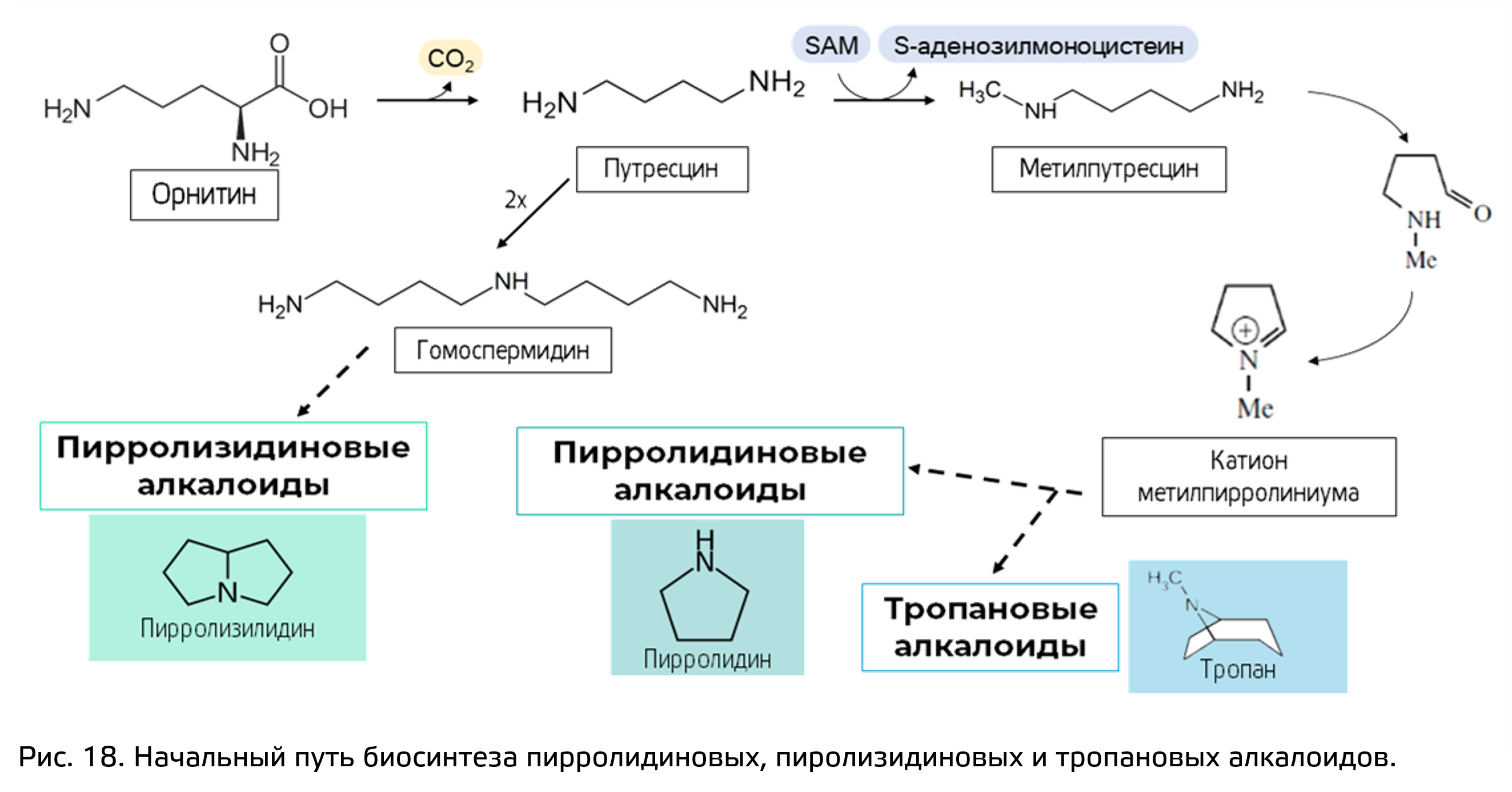
В случае синтеза пирролидиновых, пиролизидиновых и тропановых алкалоидов из орнитина получается диамин путрисцин. Именно на этом этапе происходит разветвление путей биосинтеза пирролидиновых и тропановых алкалоидов и пиролизидиновых алкалоидов. В первом случае путрисцин подвергается реакции метилирования при помощи SAM и после окисления образует катион метиллпирролиниума (основание Шиффа). Он может вступать в реакции, например, с ацетил-КоА, в результате чего у гетероцикла образуется дополнительная боковая цепочка. Этот путь дает начало всем пиролидиновым алкалоидам, а они в свою очередь могут давать начало тропановым алкалоидам.
Но с путрисцином может произойти реакция димеризации, в результате чего образуется гомоспермидин. Он также последовательно циклизуется и дает уже пиролизидиновый скелет.
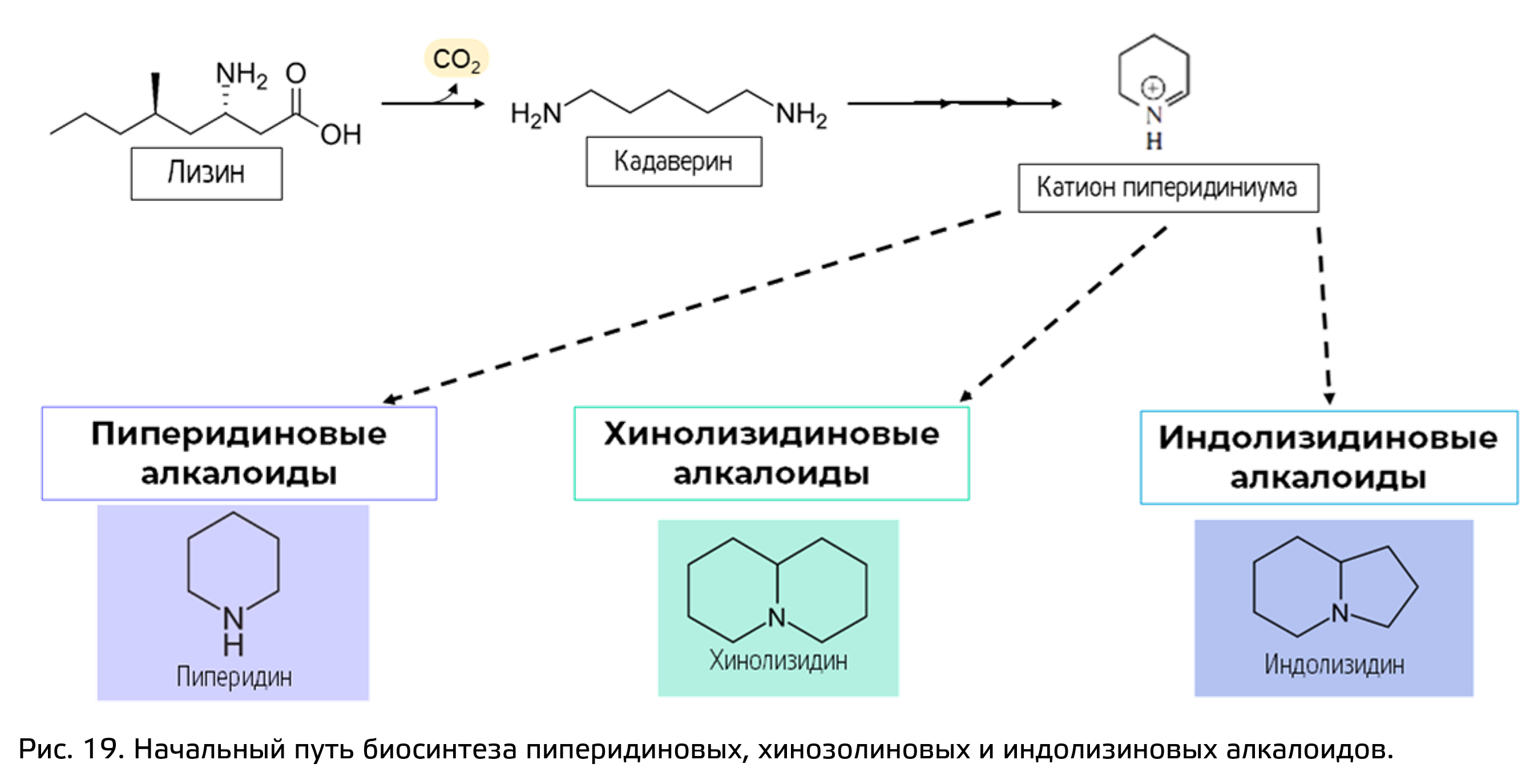
Аналогичным образом синтезируются пипиридиновые, хинолизидиновые и индолизидиновые алкалоиды, только синтез их берёт свое начало с лизина (рис. 19). Как и в предыдущем случае, биосинтез начинается с реакции декарбоксилирования лизина и образования специфичного продукта – кадаверина. Затем он окисляется до альдегида и с образованием шиффового основания происходит циклизация молекулы. Образуется катион пиперидиниум.
Этот катион пиперидиниума в первую очередь дает начало пиперидиновым алкалоидам. Группа структурно достаточно разнообразна и имеет самые разные заместители в разных положениях относительно гетероцикла.
Хинолизидиновые и индолизидиновые алкалоиды имеют два кольца, но связаны с пиперидиновыми биосинтетически. И если хинолизидиновые алкалоиды получаются путём димеризации двух пиперидиновых предшественников, то второй цикл у индолизидиновых алкалоидов образован за счет реакции с ацетил-КоА.
Но наибольшее разнообразие всех алкалоидов дают ароматические аминокислоты, а они синтезируются по шикиматному пути. Так из тирозина синтезируются изохинолиновые алкалоиды. Из триптофана берут начало индольные алкалоиды. Кроме того, из того же триптофана синтезируется антраниловая кислота, которая дает начало хинолиновым, хиназолиновым и акридоновым алкалоидам (рис. 20).
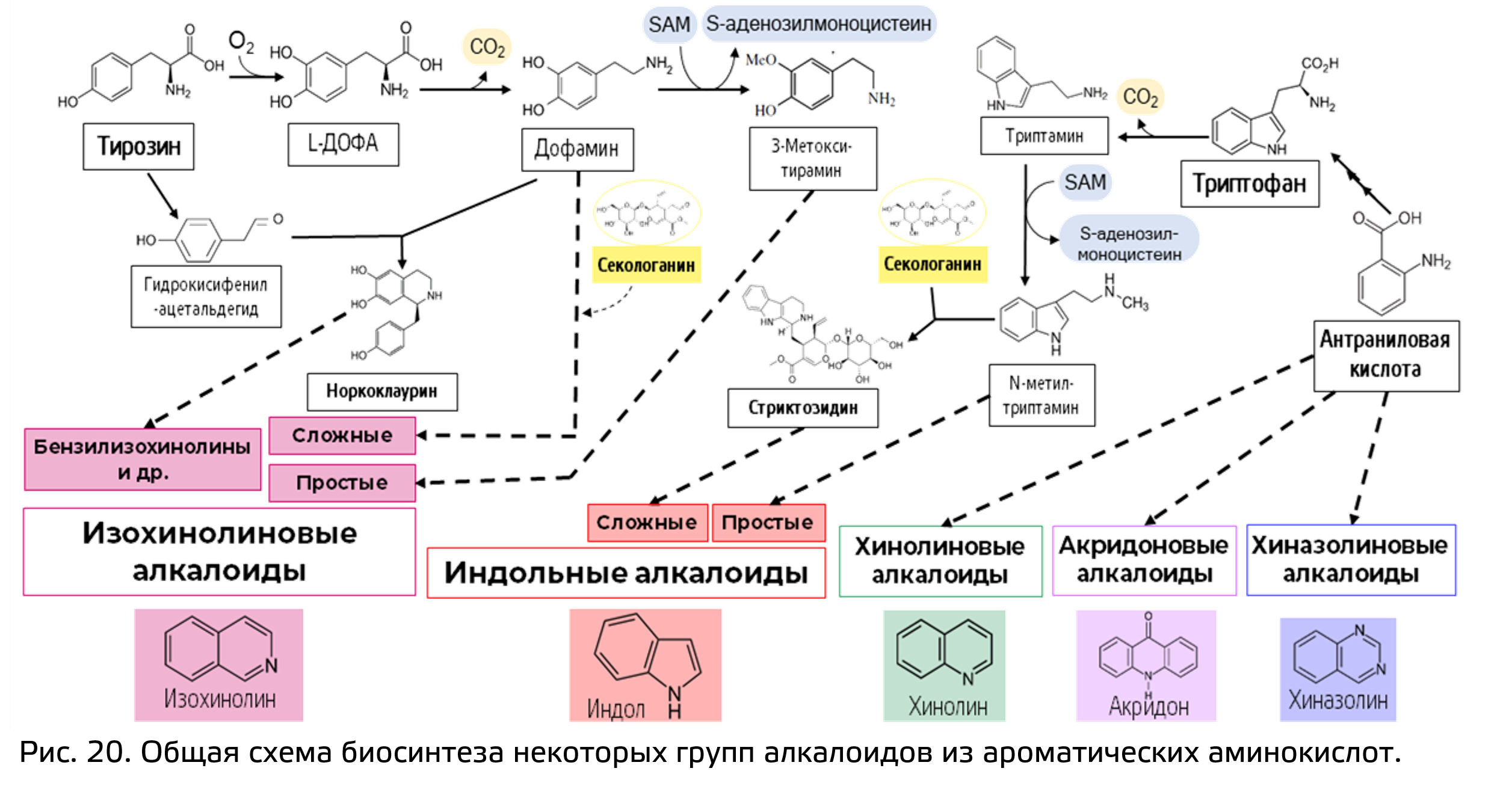
Интересно, что среди изозинолиновых и индольных алкалоидов выделяют группы сложных изохинолиновых и сложных индольных алкалоидов. Обе эти группы отличает то, что к алкалоидному скелету присоединяется монотерпеноид секологанин. То есть, строго говоря, по классификации их можно было бы отнести к псевдопалкалоидам, но все таки биосинтетически они связаны с истинными алкалоидами и азот у них находиться в гетероцикле.
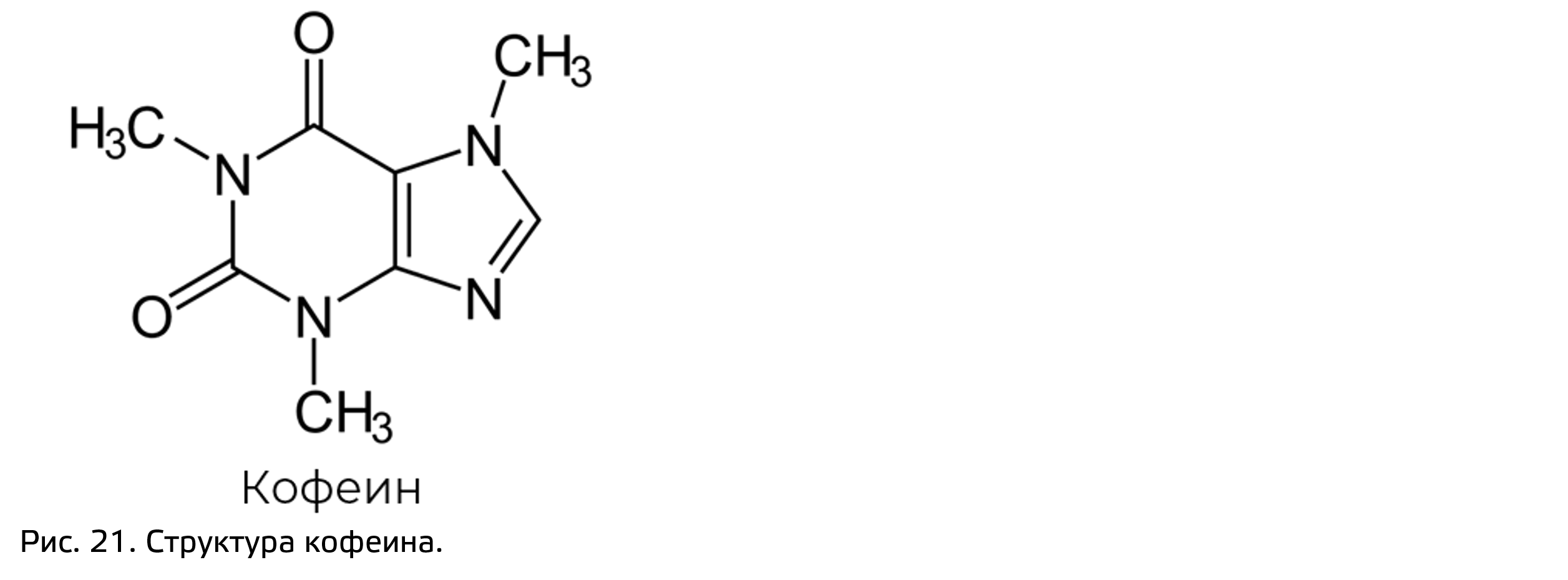
Есть также алкалоиды, биосинтез которых начинается с путей образования пуринов и пиримидинов. К примеру, производным пурина является алкалоид кофеин (рис. 21), а пиримидинам — никотин.
Разнообразие алкалоидов.
- Истинные алкалоиды.
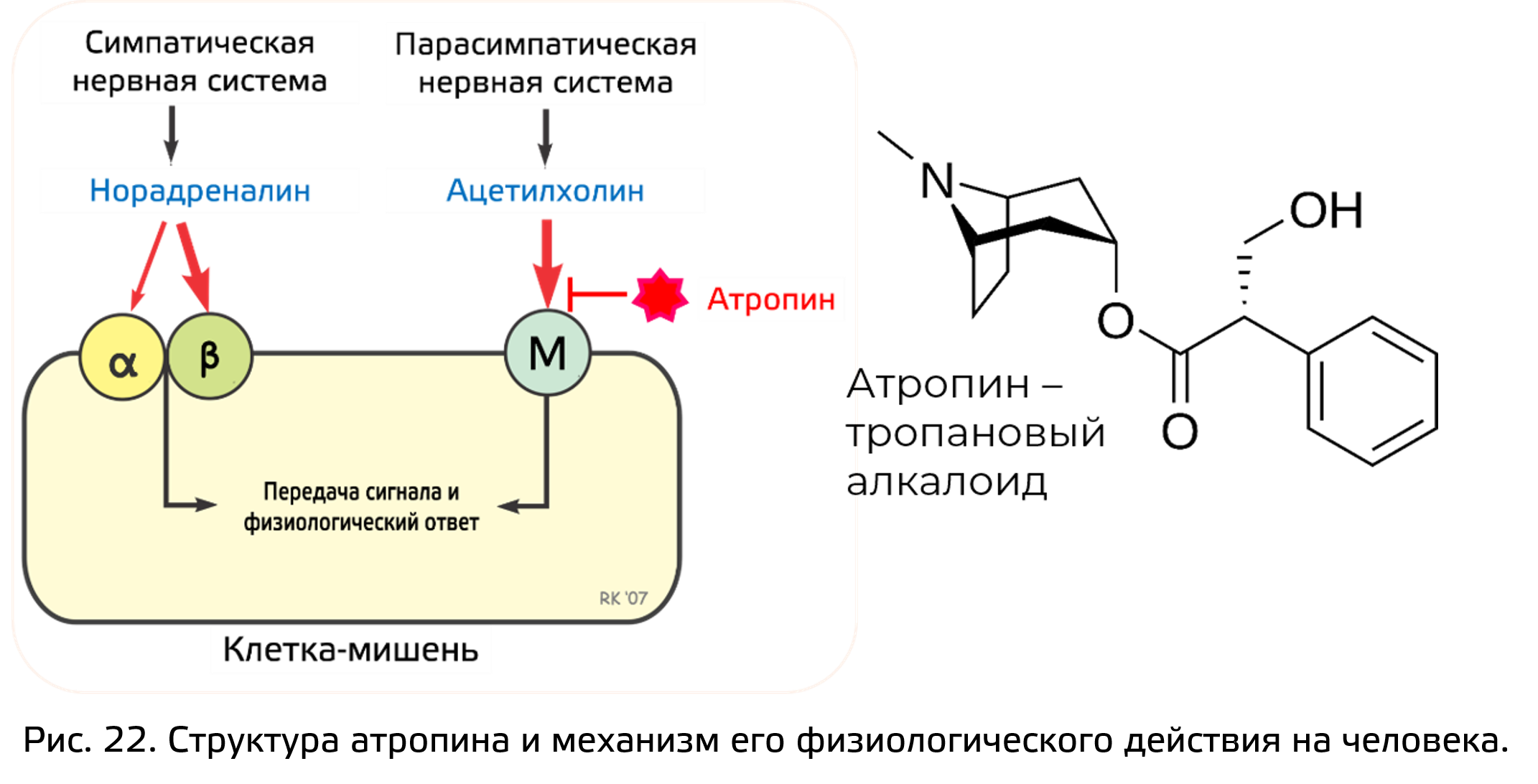
Наверняка, вы знакомы с поговоркой «белены объелся». То, что содержится в белене – тропановый алкалоид, синтезирующийся из орнитина и возможно знакомый вам из лекций или учебников по физиологии животных – атропин (рис. 22). Атропин блокирует M-холинорецепторы, расположенные в парасимпатической нервной системе, на мембране органов-мишеней. Блокируя м-холинорецепторы, он делает их нечувствительными к ацетилхолину в области окончаний постганглионарных парасимпатических (холинергических) нервов. Подобное вызывает эффекты, противоположные эффектам, наблюдающимся при возбуждении парасимпатических нервов.
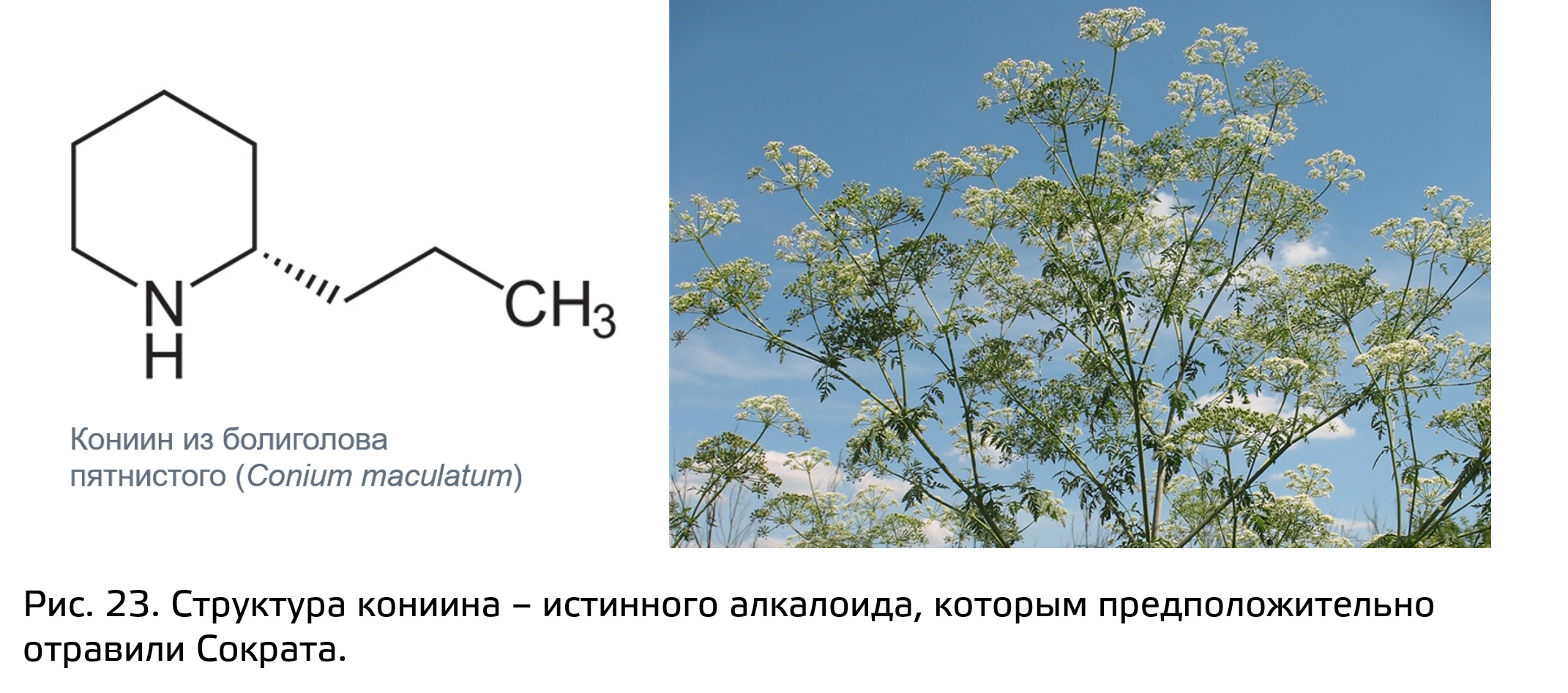
Среди пиперидиновых алкалоидов есть интересное вещество, которым по некоторым данным, отравили Сократа. Это вещество называется кониин (рис. 23) и содержится в большом количестве в растении болиголове пятнистом (Conium maculatum). Но кроме этого интересно еще то, что несмотря на свою пиперидиновую структуру это вещество биосинтетически совсем не пиперидиновый алкалоид, поскольку его биосинтез связан с жирными кислотами и берет свое начало из ацетата и малоната, а азот, хоть и входит в состав гетероцикла, привносится туда путем трансаминирования на завершающих этапах биосинтеза.
Интересным примером изохинолиновых алкалоидов является папаверин (рис. 24) из Опийного мака (Papaver somnifera). Этот алкалоид отноистся к бензилихохинолинам.

Этот алкалоид приводит к расслаблению гладких мышц сосудов, и это приводит к снижению давления. Основное использование – как спазмолитик и гипотензивное средство. И у него есть полусинтетических аналог – всем известный препарат но-шпа (дротаверин). Дротаверин представляет собой собой производное изохинолина, которое проявляет мощное спазмолитическое действие на гладкую мускулатуру за счет ингибирования фосфодиэстеразы IV типа (ФДЭ IV). Ингибирование фермента ФДЭ IV приводит к повышению концентрации цАМФ, что приводит к инактивации киназы легкой цепи миозина. И это в дальнейшем вызывает расслабление гладкой мускулатуры.
Изохинолины могут димеризоваться. Ярким примером подобных веществ является тубокурарин из млечного сока луносемянниковых Menispermaceae (рис. 25). Это растение использовали южно-американские аборигены для создания ядов кураре, которым они смазывали на стрелы для охоты. На животных яд кураре действует мгновенно и убивает животное. Вообще состав яда кураре может различаться в зависимости от племени и региона.

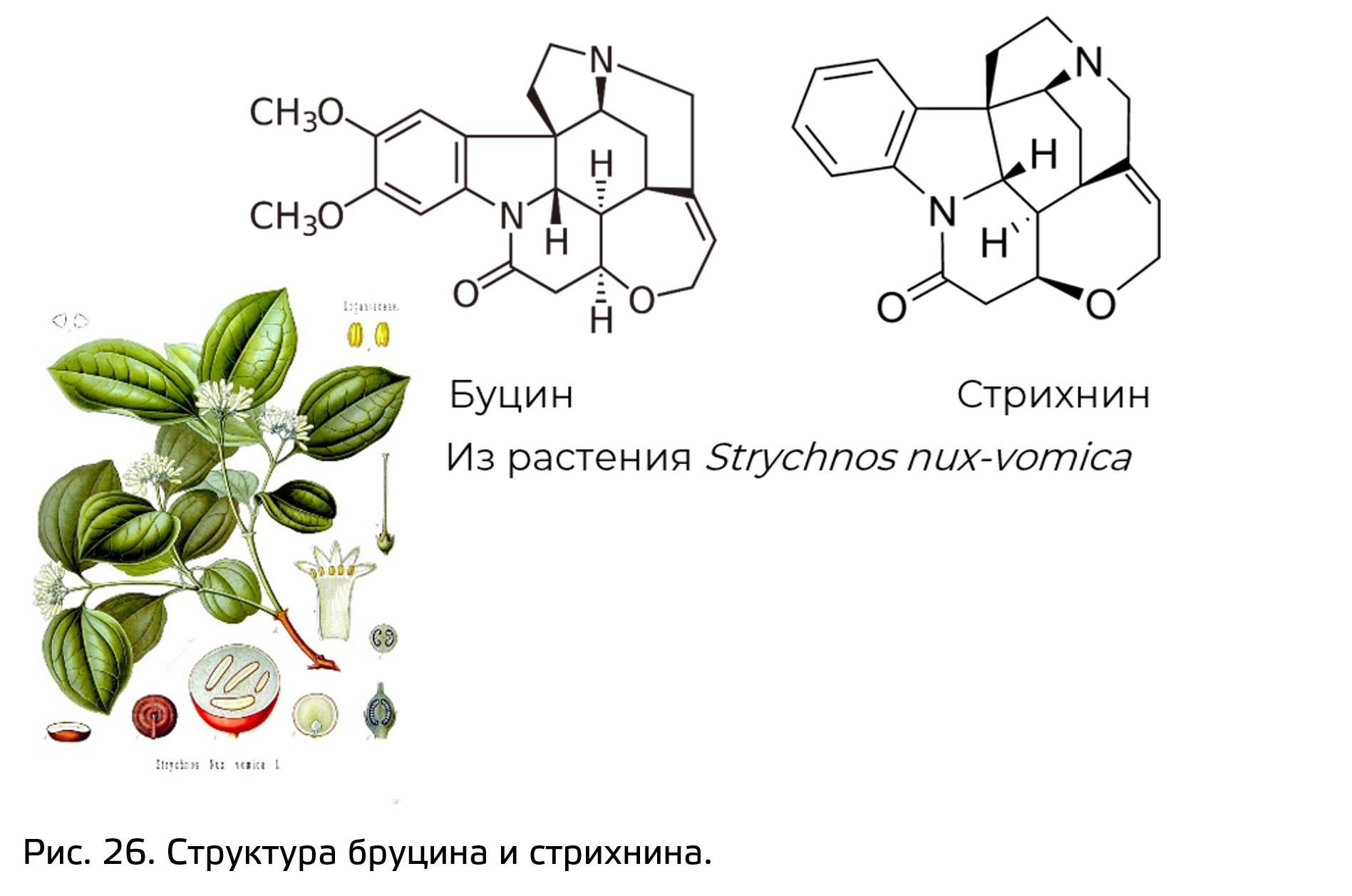
Например, среди индольных алкалоидов, а точнее сложных индольных алкалоидов (тех, которые соединяются с монотерпеноидом секологанином), также есть вещества, которые использовались ранее в ядах кураре. Такими веществами являются стрихнин и бруцин (рис. 26). При попадании в кровь бруцин подавляет действие холинэстеразы, результатом чего является мышечный и дыхательный паралич. Бруцин вызывает сильное сердцебиение, которое вскоре приводит к полной остановке сердца. Стрихнин, принятый с едой действует несколько иначе. Дело в том, что стрихнин также действуют на рецепторы глицина в клетках Реншоу (вспомните про возвратное торможение, один из видов постсинаптического торможения в нейронах ЦНС). Это приводит к тому, что при возникновении ПД не возникает его торможения после генерации, так что мышца начинает судорожно сокращаться (тетанические судороги). Раньше стрихнин использовали для того, чтобы избавиться от насекомых и мышей.
Ярком примером хинолиновых алкалоидов является хинин из коры хинного дерева (рис. 27).
Хинин был первым препаратом, используемым для лечения малярии. Сейчас малярийный плазмодий уже выработал устойчивость к этому веществу, но в то же время это был большой шаг в лечении болезни, которая на сегодняшний день ежегодно забирает жизни 1,3—3 миллиона людей.

- Протоалкалоиды.
Довольно интересными примерами также богаты протоалкалоиды, то есть те алкалоиды, которые имеют азот в алифатический части. Остальная часть скелета у них может иметь аминокислотное происхождение, как и в случае истинных алкалоидов (к примеру в случае протоалкалоидов, биосинтез которых берёт свое начало из фенилаланина – фенилалкиламинов).
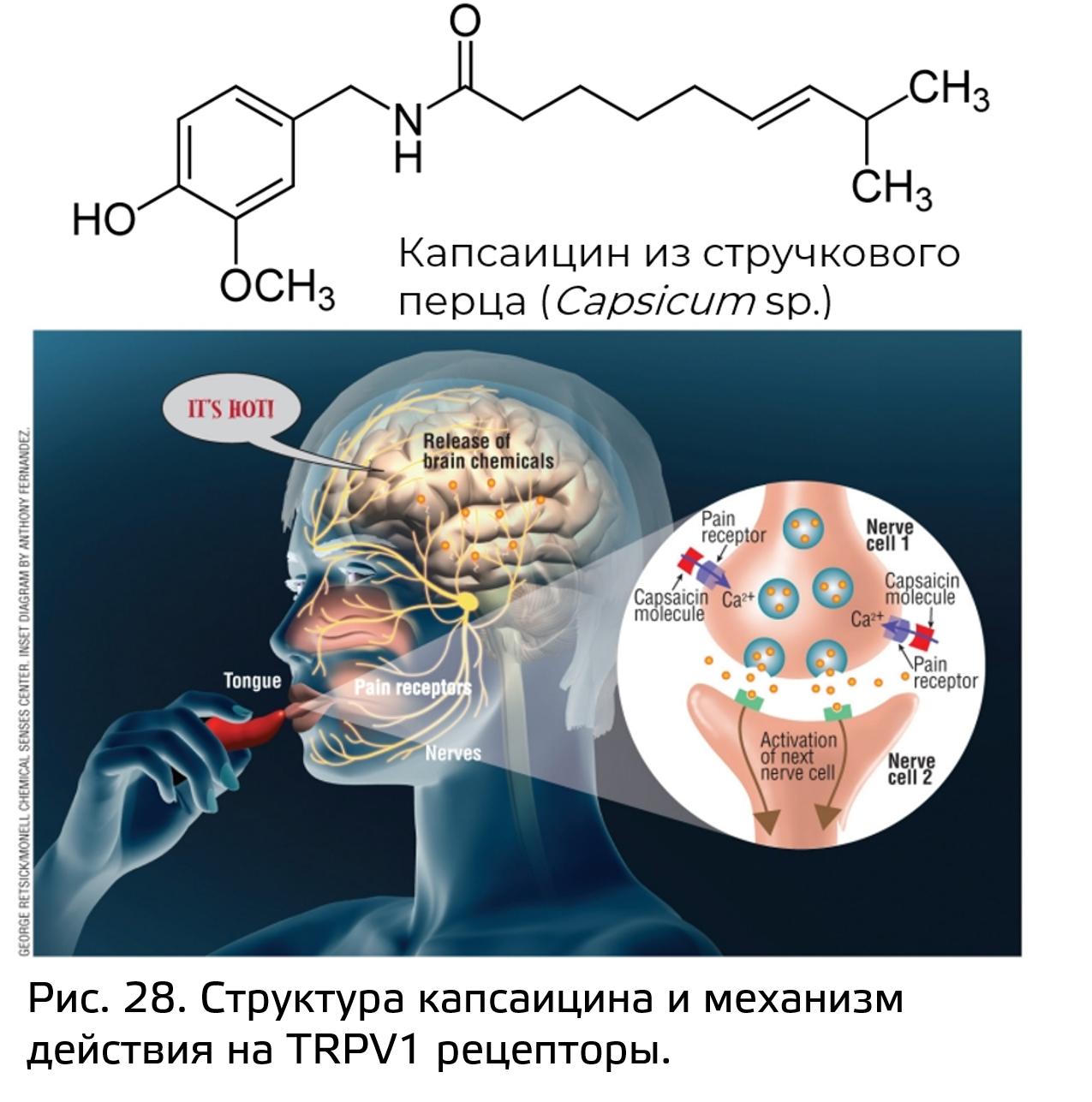
Интересным протоалкалоидом является капсаицин (рис. 28). Он обуславливает жгучий эффект от перца при раздражении рецепторов. Капсаицин связывается с рецептором, называемым ваниллоидным, или капсоициновым, рецептором подтипа 1 (TRPV1), который связан с работой калиевого канала. TRPV1 является рецептором ионного канала и может стимулироваться теплом, протонами и механически. Активированные каналы позволяют катионам проходить через клеточную мембрану. Возникающая в результате деполяризация нейрона стимулирует передачу сигнала в мозг. Так, связываясь с рецептором TRPV1, молекула капсаицина вызывает ощущения, аналогичные ощущениям от чрезмерного нагрева или жжения. За открытие этих рецепторов в 2021 году была присуждена Нобелевская премия по медицине.
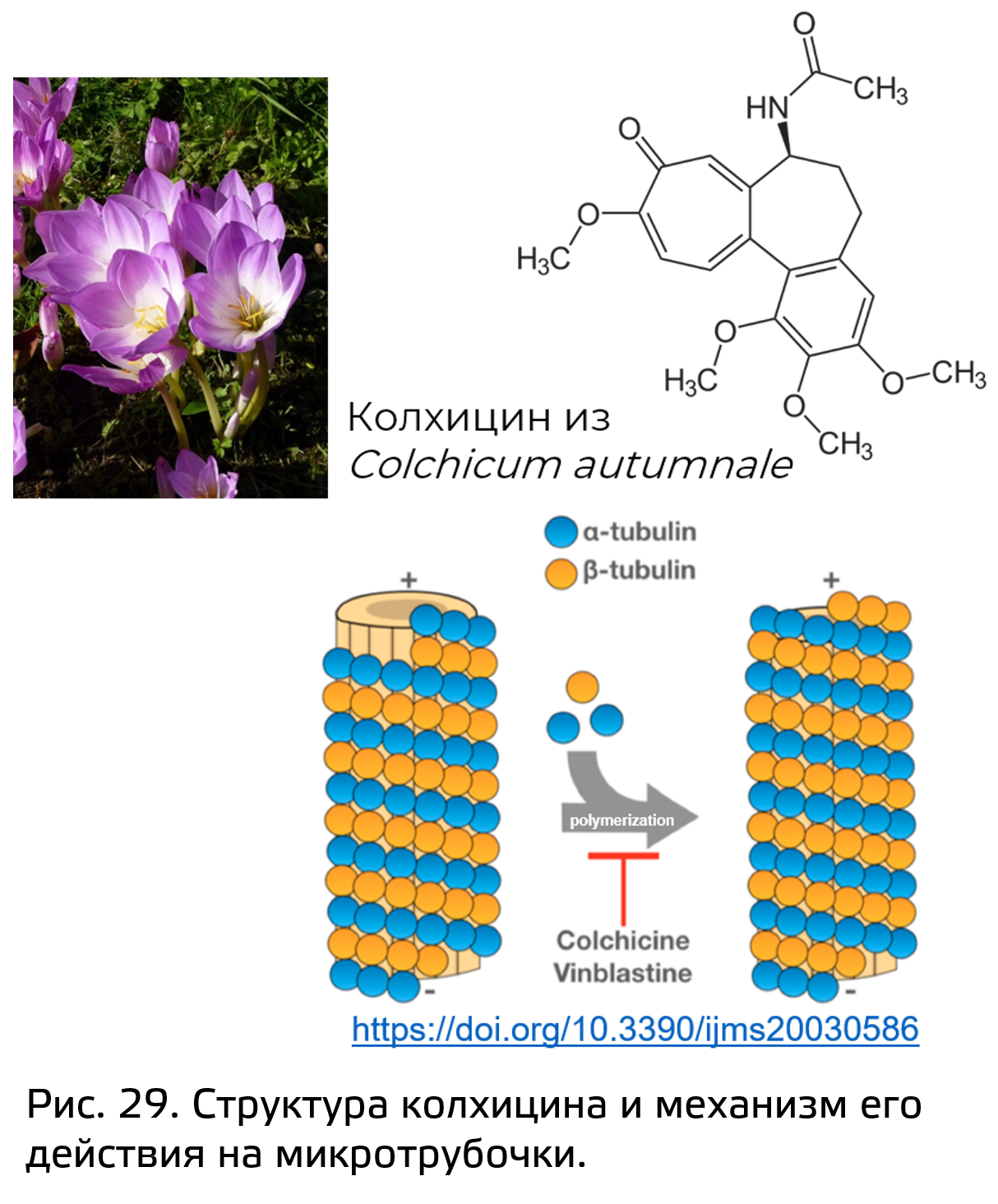
Отдельной группой протоалкалоидов можно выделить колхициновые производные (рис. 29). К ним непосредственно относятся колхицины и колхамины, представляющие собой митотические яды. Они нарушают нормальное течение митоза, поскольку нарушают деполимеризацию микротрубочек. Это в свою очередь приводит к полиплоидизации.
- Псевдоалкалоиды.
Псевдоалкалоиды – вещества, имеющие терпеноидную природу и имеющие в своем составе азот, - также весьма разнообразны и интересны.
К примеру, аконитин (рис. 30) – один из самых сильных и быстро всасывающихся ядов, имеющий атом азота в составе цикла и связанный с биосинтезом дитерпеноидов (дитерпеновый псевдоалкалоид). Он возбуждает, затем парализует окончания чувствительных нервов. Оказывает рефлекторное влияние на сердце и органы дыхания, позднее наступает паралич центров головного и спинного мозга. Аконитин встречается в некоторых видах рода Aconitum и Delphinium.

К тритерпеновым псевдоалкалоидам относится довольно большое число соединений, в частности те, что отвественны за ядовитые свойства пасленовых, например такие как томатидин и соланин (рис. 31).
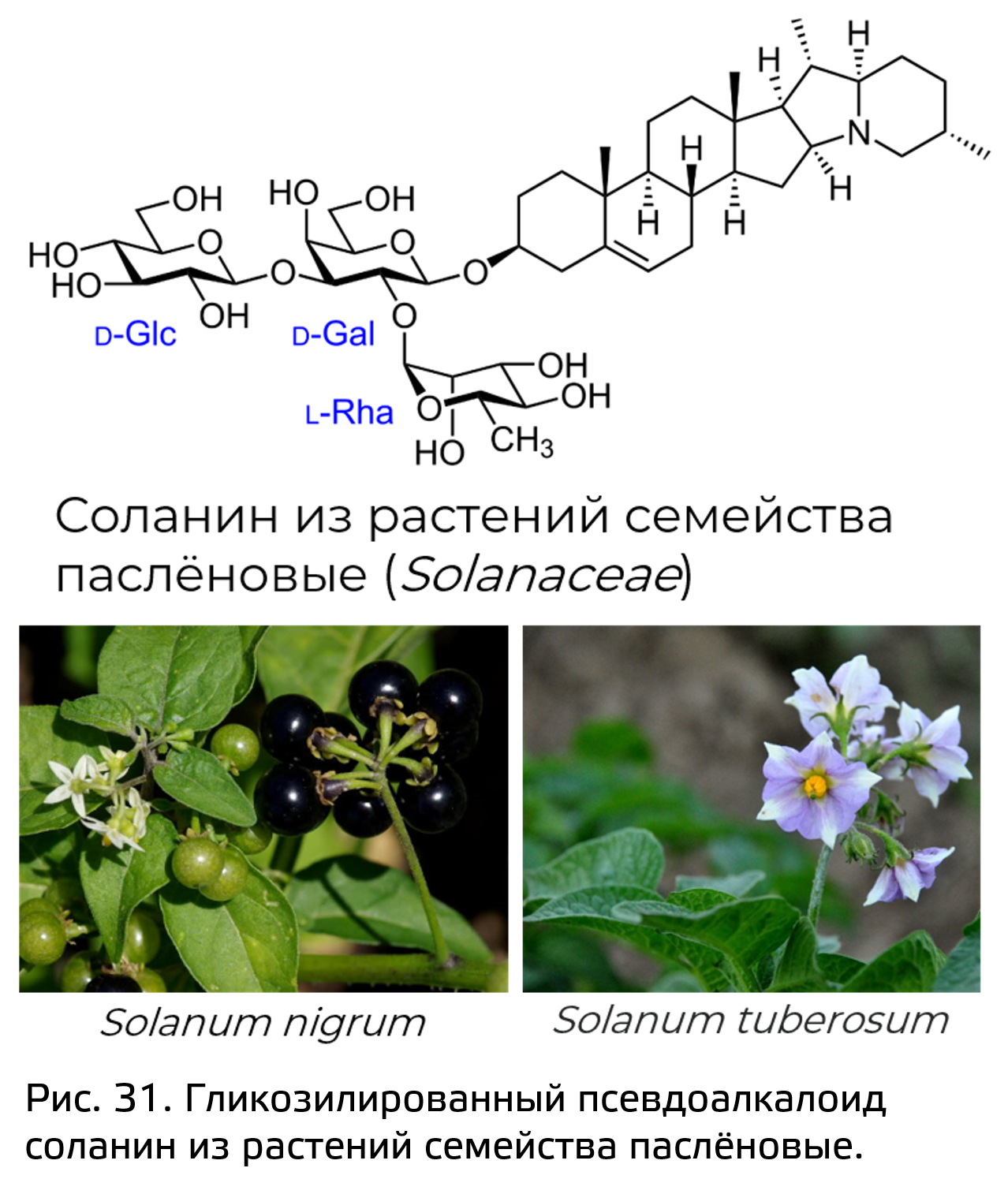
Зачастую они выполняют защитную функцию в растении. Подавляют развитие грибов, отпугивают насекомых. Накопление таких алкалоидов позволяет приобрести устойчивость к колорадскому жуку у диких типов пасленовых. Обычно такое вещества находятся в виде гликозилированных производных. Например вещество соланидин образуя контюгаты с глюкозами, превращается в соланин.
